[English] 日本語
 Yorodumi
Yorodumi- PDB-2x0o: Apo structure of the Alcaligin biosynthesis protein C (AlcC) from... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2x0o | ||||||
|---|---|---|---|---|---|---|---|
| Title | Apo structure of the Alcaligin biosynthesis protein C (AlcC) from Bordetella bronchiseptica | ||||||
 Components Components | ALCALIGIN BIOSYNTHESIS PROTEIN | ||||||
 Keywords Keywords | BIOSYNTHETIC PROTEIN / ALCALIGIN BIOSYNTHESIS / ADENYLATION / SIDEROPHORES / IRON ACQUISITION | ||||||
| Function / homology |  Function and homology information Function and homology information | ||||||
| Biological species |  BORDETELLA BRONCHISEPTICA (bacteria) BORDETELLA BRONCHISEPTICA (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.4 Å MOLECULAR REPLACEMENT / Resolution: 2.4 Å | ||||||
 Authors Authors | Johnson, K.A. / Schmelz, S. / Kadi, N. / Mcmahon, S.A. / Oke, M. / Liu, H. / Carter, L.G. / White, M.F. / Challis, G.L. / Naismith, J.H. | ||||||
 Citation Citation |  Journal: J.Struct.Funct.Genomics / Year: 2010 Journal: J.Struct.Funct.Genomics / Year: 2010Title: The Scottish Structural Proteomics Facility: Targets, Methods and Outputs. Authors: Oke, M. / Carter, L.G. / Johnson, K.A. / Liu, H. / Mcmahon, S.A. / Yan, X. / Kerou, M. / Weikart, N.D. / Kadi, N. / Sheikh, M.A. / Schmelz, S. / Dorward, M. / Zawadzki, M. / Cozens, C. / ...Authors: Oke, M. / Carter, L.G. / Johnson, K.A. / Liu, H. / Mcmahon, S.A. / Yan, X. / Kerou, M. / Weikart, N.D. / Kadi, N. / Sheikh, M.A. / Schmelz, S. / Dorward, M. / Zawadzki, M. / Cozens, C. / Falconer, H. / Powers, H. / Overton, I.M. / Van Niekerk, C.A.J. / Peng, X. / Patel, P. / Garrett, R.A. / Prangishvili, D. / Botting, C.H. / Coote, P.J. / Dryden, D.T.F. / Barton, G.J. / Schwarz-Linek, U. / Challis, G.L. / Taylor, G.L. / White, M.F. / Naismith, J.H. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2x0o.cif.gz 2x0o.cif.gz | 242.6 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2x0o.ent.gz pdb2x0o.ent.gz | 194.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2x0o.json.gz 2x0o.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/x0/2x0o https://data.pdbj.org/pub/pdb/validation_reports/x0/2x0o ftp://data.pdbj.org/pub/pdb/validation_reports/x0/2x0o ftp://data.pdbj.org/pub/pdb/validation_reports/x0/2x0o | HTTPS FTP |
|---|
-Related structure data
| Related structure data | 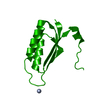 2ivyC  2jg5C  2jg6C  2vw8C  2vxzC  2wj9C  2x3dC  2x3eC  2x3fC  2x3gC  2x3lC  2x3mC  2x3nC  2x3oC  2x48C  2x4gC  2x4hC  2x4iC  2x4jC  2x4kC  2x4lC  2x5cC  2x5dC  2x5fC  2x5gC  2x5hC  2x5pC  2x5qC  2x5rC  2x5tC  2x7bC  2x7iC  2xu2C  3ffeS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 70047.992 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  BORDETELLA BRONCHISEPTICA (bacteria) / Plasmid: PET-151/TOPO / Production host: BORDETELLA BRONCHISEPTICA (bacteria) / Plasmid: PET-151/TOPO / Production host:  | ||
|---|---|---|---|
| #2: Chemical | ChemComp-SO4 / #3: Water | ChemComp-HOH / | |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.1 Å3/Da / Density % sol: 41 % / Description: NONE |
|---|---|
| Crystal grow | pH: 6 Details: 1.4M MG-SULFATE, 0.1M NA-CACODYLATE, PH6.0, 0.1M LI-SULFATE |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  ESRF ESRF  / Beamline: BM14 / Wavelength: 1.000005 / Beamline: BM14 / Wavelength: 1.000005 |
| Detector | Type: MARRESEARCH / Detector: CCD / Date: Mar 14, 2007 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.000005 Å / Relative weight: 1 |
| Reflection | Resolution: 2.4→40 Å / Num. obs: 23068 / % possible obs: 97.9 % / Observed criterion σ(I): 3.3 / Redundancy: 4.1 % / Biso Wilson estimate: 32 Å2 / Rmerge(I) obs: 0.09 / Net I/σ(I): 17.1 |
| Reflection shell | Resolution: 2.4→2.49 Å / Redundancy: 3.7 % / Rmerge(I) obs: 0.49 / Mean I/σ(I) obs: 3.3 / % possible all: 99.1 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 3FFE Resolution: 2.4→42.901 Å / SU ML: 0.32 / σ(F): 1.99 / Phase error: 22.08 / Stereochemistry target values: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL / Bsol: 37.938 Å2 / ksol: 0.367 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 32.1 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.4→42.901 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller














 PDBj
PDBj


