+ データを開く
データを開く
- 基本情報
基本情報
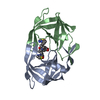
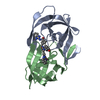
| 登録情報 | データベース: PDB / ID: 4b3q | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structures of HIV-1 RT and RNA-DNA Complex Reveal a Unique RT Conformation and Substrate Interface | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | HYDROLASE/DNA/RNA / HYDROLASE-DNA-RNA COMPLEX / RNASE H / HYBRID | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報integrase activity / Integration of viral DNA into host genomic DNA / Autointegration results in viral DNA circles / Minus-strand DNA synthesis / Plus-strand DNA synthesis / 2-LTR circle formation / Uncoating of the HIV Virion / Vpr-mediated nuclear import of PICs / Early Phase of HIV Life Cycle / Integration of provirus ...integrase activity / Integration of viral DNA into host genomic DNA / Autointegration results in viral DNA circles / Minus-strand DNA synthesis / Plus-strand DNA synthesis / 2-LTR circle formation / Uncoating of the HIV Virion / Vpr-mediated nuclear import of PICs / Early Phase of HIV Life Cycle / Integration of provirus / APOBEC3G mediated resistance to HIV-1 infection / Binding and entry of HIV virion / viral life cycle / Assembly Of The HIV Virion / Budding and maturation of HIV virion / HIV-1 retropepsin / symbiont-mediated activation of host apoptosis / retroviral ribonuclease H / exoribonuclease H / exoribonuclease H activity / host multivesicular body / protein processing / viral genome integration into host DNA / RNA-directed DNA polymerase / establishment of integrated proviral latency / viral penetration into host nucleus / RNA stem-loop binding / RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / peptidase activity / host cell / viral nucleocapsid / DNA recombination / DNA-directed DNA polymerase / aspartic-type endopeptidase activity / 加水分解酵素; エステル加水分解酵素 / DNA-directed DNA polymerase activity / symbiont-mediated suppression of host gene expression / viral translational frameshifting / lipid binding / symbiont entry into host cell / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity / DNA binding / zinc ion binding / identical protein binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   HUMAN IMMUNODEFICIENCY VIRUS 1 (ヒト免疫不全ウイルス) HUMAN IMMUNODEFICIENCY VIRUS 1 (ヒト免疫不全ウイルス)synthetic construct (人工物) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 5 Å 分子置換 / 解像度: 5 Å | |||||||||
 データ登録者 データ登録者 | Lapkouski, M. / Tian, L. / Miller, J.T. / Le Grice, S.F.J. / Yang, W. | |||||||||
 引用 引用 |  ジャーナル: Nat.Struct.Mol.Biol. / 年: 2013 ジャーナル: Nat.Struct.Mol.Biol. / 年: 2013タイトル: Complexes of HIV-1 RT, Nnrti and RNA/DNA Hybrid Reveal a Structure Compatible with RNA Degradation 著者: Lapkouski, M. / Tian, L. / Miller, J.T. / Le Grice, S.F.J. / Yang, W. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4b3q.cif.gz 4b3q.cif.gz | 229.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4b3q.ent.gz pdb4b3q.ent.gz | 173.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4b3q.json.gz 4b3q.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  4b3q_validation.pdf.gz 4b3q_validation.pdf.gz | 781.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  4b3q_full_validation.pdf.gz 4b3q_full_validation.pdf.gz | 797.8 KB | 表示 | |
| XML形式データ |  4b3q_validation.xml.gz 4b3q_validation.xml.gz | 38.1 KB | 表示 | |
| CIF形式データ |  4b3q_validation.cif.gz 4b3q_validation.cif.gz | 50.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/b3/4b3q https://data.pdbj.org/pub/pdb/validation_reports/b3/4b3q ftp://data.pdbj.org/pub/pdb/validation_reports/b3/4b3q ftp://data.pdbj.org/pub/pdb/validation_reports/b3/4b3q | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 64423.855 Da / 分子数: 1 / 変異: YES / 由来タイプ: 組換発現 由来: (組換発現)   HUMAN IMMUNODEFICIENCY VIRUS 1 (ヒト免疫不全ウイルス) HUMAN IMMUNODEFICIENCY VIRUS 1 (ヒト免疫不全ウイルス)発現宿主:  参照: UniProt: P04585, RNA-directed DNA polymerase, DNA-directed DNA polymerase, retroviral ribonuclease H, exoribonuclease H, HIV-1 retropepsin |
|---|---|
| #2: タンパク質 | 分子量: 52973.785 Da / 分子数: 1 / 変異: YES / 由来タイプ: 組換発現 由来: (組換発現)   HUMAN IMMUNODEFICIENCY VIRUS 1 (ヒト免疫不全ウイルス) HUMAN IMMUNODEFICIENCY VIRUS 1 (ヒト免疫不全ウイルス)発現宿主:  |
| #3: DNA鎖 | 分子量: 7670.942 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
| #4: RNA鎖 | 分子量: 10779.513 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
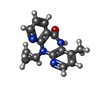
| #5: 化合物 | ChemComp-NVP / |
| 配列の詳細 | P66 MUTATIONS S68G, R83K, I411V, N477S, R461K, Y483H, D498N, V559I P51 MUTATIONS S68G, R83K, I411V, ...P66 MUTATIONS S68G, R83K, I411V, N477S, R461K, Y483H, D498N, V559I P51 MUTATIONS S68G, R83K, I411V, N-TERMINAL MRGSHHHHHH |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 6 Å3/Da / 溶媒含有率: 82 % / 解説: NONE |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法 / pH: 8.5 詳細: RT COMPLEX WAS MIXED WITH RESERVOIR SOLUTION CONTAINING 1.8M (NH4)2SO4, 50MM TRIS HCL (PH8.5), AND 25MM MGSO4. VAPOR DIFFUSION 4C. |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 23-ID-B / 波長: 1 / ビームライン: 23-ID-B / 波長: 1 |
| 検出器 | タイプ: MARRESEARCH MAR300 / 検出器: CCD / 日付: 2011年7月9日 / 詳細: ADJUSTABLE FOCUS K-B PAIR SI MIRRORS |
| 放射 | モノクロメーター: DOUBLE CRYSTAL CRYO-COOLED SI(111) プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 5→60 Å / Num. obs: 14646 / % possible obs: 99.6 % / Observed criterion σ(I): 2 / 冗長度: 6.5 % / Biso Wilson estimate: 170.34 Å2 / Rsym value: 0.14 / Net I/σ(I): 14.8 |
| 反射 シェル | 解像度: 5→5.09 Å / 冗長度: 6.8 % / Mean I/σ(I) obs: 1.7 / Rsym value: 0.87 / % possible all: 100 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRIES 1RTD, 1FK9 解像度: 5→29.987 Å / SU ML: 1.13 / σ(F): 1 / 位相誤差: 49.26 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 149 Å2 | ||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 5→29.987 Å
| ||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー































































































 PDBj
PDBj