+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3dng | ||||||
|---|---|---|---|---|---|---|---|
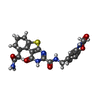
| タイトル | Crystal structure of the complex between MMP-8 and a non-zinc chelating inhibitor | ||||||
 要素 要素 | Neutrophil collagenase | ||||||
 キーワード キーワード | HYDROLASE / selective inhibition / non-zinc chelating inhibitors / Calcium / Collagen degradation / Extracellular matrix / Glycoprotein / Metal-binding / Metalloprotease / Polymorphism / Protease / Secreted / Zinc / Zymogen | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報neutrophil collagenase / tumor necrosis factor binding / positive regulation of microglial cell activation / positive regulation of neuroinflammatory response / positive regulation of tumor necrosis factor-mediated signaling pathway / Activation of Matrix Metalloproteinases / endodermal cell differentiation / Collagen degradation / collagen catabolic process / extracellular matrix disassembly ...neutrophil collagenase / tumor necrosis factor binding / positive regulation of microglial cell activation / positive regulation of neuroinflammatory response / positive regulation of tumor necrosis factor-mediated signaling pathway / Activation of Matrix Metalloproteinases / endodermal cell differentiation / Collagen degradation / collagen catabolic process / extracellular matrix disassembly / Degradation of the extracellular matrix / extracellular matrix organization / metalloendopeptidase activity / specific granule lumen / positive regulation of tumor necrosis factor production / tertiary granule lumen / peptidase activity / : / cellular response to lipopolysaccharide / endopeptidase activity / serine-type endopeptidase activity / Neutrophil degranulation / proteolysis / extracellular space / extracellular region / zinc ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Pochetti, G. / Montanari, R. / Mazza, F. | ||||||
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2009 ジャーナル: J.Med.Chem. / 年: 2009タイトル: Extra Binding Region Induced by Non-Zinc Chelating Inhibitors into the S(1)' Subsite of Matrix Metalloproteinase 8 (MMP-8) 著者: Pochetti, G. / Montanari, R. / Gege, C. / Chevrier, C. / Taveras, A.G. / Mazza, F. #1:  ジャーナル: Chem.Biol. / 年: 2005 ジャーナル: Chem.Biol. / 年: 2005タイトル: Structural basis for the highly selective inhibition of MMP-13 著者: Engel, C.K. / Pirard, B. / Schimanski, S. / Kirsch, R. / Habermann, J. / Klingler, O. / Schlotte, V. / Weithmann, K.U. / Wendt, K.U. #2:  ジャーナル: J.Biol.Chem. / 年: 2007 ジャーナル: J.Biol.Chem. / 年: 2007タイトル: Discovery and characterization of a novel inhibitor of matrix metalloprotease-13 that reduces cartilage damage in vivo without joint fibroplasia side effects 著者: Johnson, A.R. / Pavlovsky, A.G. / Ortwine, D.F. / Prior, F. / Man, C.F. / Bornemeier, D.A. / Banotai, C.A. / Mueller, W.T. / McConnell, P. / Yan, C. / Baragi, V. / Lesch, C. / Roark, W.H. / ...著者: Johnson, A.R. / Pavlovsky, A.G. / Ortwine, D.F. / Prior, F. / Man, C.F. / Bornemeier, D.A. / Banotai, C.A. / Mueller, W.T. / McConnell, P. / Yan, C. / Baragi, V. / Lesch, C. / Roark, W.H. / Wilson, M. / Datta, K. / Guzman, R. / Han, H.K. / Dyer, R.D. #3:  ジャーナル: J.Mol.Biol. / 年: 2004 ジャーナル: J.Mol.Biol. / 年: 2004タイトル: Crystal structures of novel non-peptidic, non-zinc chelating inhibitors bound to MMP-12 著者: Morales, R. / Perrier, S. / Florent, J.M. / Beltra, J. / Dufour, S. / De Mendez, I. / Manceau, P. / Tertre, A. / Moreau, F. / Compere, D. / Dublanchet, A.C. / O'Gara, M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3dng.cif.gz 3dng.cif.gz | 89.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3dng.ent.gz pdb3dng.ent.gz | 66.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3dng.json.gz 3dng.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3dng_validation.pdf.gz 3dng_validation.pdf.gz | 941.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3dng_full_validation.pdf.gz 3dng_full_validation.pdf.gz | 953.8 KB | 表示 | |
| XML形式データ |  3dng_validation.xml.gz 3dng_validation.xml.gz | 21.1 KB | 表示 | |
| CIF形式データ |  3dng_validation.cif.gz 3dng_validation.cif.gz | 29.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/dn/3dng https://data.pdbj.org/pub/pdb/validation_reports/dn/3dng ftp://data.pdbj.org/pub/pdb/validation_reports/dn/3dng ftp://data.pdbj.org/pub/pdb/validation_reports/dn/3dng | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 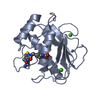
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 18111.744 Da / 分子数: 2 / 断片: MMP-8 catalytic domain, UNP residues 100-262 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MMP8, CLG1 / プラスミド: pSVB30 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MMP8, CLG1 / プラスミド: pSVB30 / 発現宿主:  #2: 化合物 | ChemComp-CA / #3: 化合物 | ChemComp-ZN / #4: 化合物 | #5: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.14 Å3/Da / 溶媒含有率: 42.41 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 6 詳細: Hanging droplets were made by mixing 1.5-3.0ml of protein/inhibitor solution with 5ml of PEG solution (10% PEG6000, 0.2M Mes-NaOH, 0.02% NaN3, pH6.0). Droplets were concentrated against a ...詳細: Hanging droplets were made by mixing 1.5-3.0ml of protein/inhibitor solution with 5ml of PEG solution (10% PEG6000, 0.2M Mes-NaOH, 0.02% NaN3, pH6.0). Droplets were concentrated against a reservoir buffer containing 1.0-2.0M sodium phosphate, 0.02% NaN3, pH6.0, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID23-2 / 波長: 0.873 Å / ビームライン: ID23-2 / 波長: 0.873 Å |
| 検出器 | タイプ: MARMOSAIC 225 mm CCD / 検出器: CCD / 日付: 2007年6月21日 |
| 放射 | モノクロメーター: Si 111 channel / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.873 Å / 相対比: 1 |
| 反射 | 解像度: 2→25 Å / Num. all: 20603 / Num. obs: 20603 / % possible obs: 99.6 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / 冗長度: 3.1 % / Biso Wilson estimate: 13.6 Å2 / Rmerge(I) obs: 0.124 / Net I/σ(I): 3.6 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1I76 解像度: 2→10 Å / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
| ||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→10 Å
| ||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





















 PDBj
PDBj