+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6v41 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | crystal structure of CDY1 chromodomain bound to H3K9me3 | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  structural genomics consortium / SGC structural genomics consortium / SGC | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Chromatin modifying enzymes / epigenetic regulation of gene expression /  histone acetyltransferase activity / histone acetyltransferase activity /  ヒストンアセチルトランスフェラーゼ / methylated histone binding / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication / ヒストンアセチルトランスフェラーゼ / methylated histone binding / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication /  DNAメチル化 ...Chromatin modifying enzymes / epigenetic regulation of gene expression / DNAメチル化 ...Chromatin modifying enzymes / epigenetic regulation of gene expression /  histone acetyltransferase activity / histone acetyltransferase activity /  ヒストンアセチルトランスフェラーゼ / methylated histone binding / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication / ヒストンアセチルトランスフェラーゼ / methylated histone binding / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication /  DNAメチル化 / Condensation of Prophase Chromosomes / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / PRC2 methylates histones and DNA / Defective pyroptosis / HDACs deacetylate histones / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / NoRC negatively regulates rRNA expression / HDMs demethylate histones / B-WICH complex positively regulates rRNA expression / PKMTs methylate histone lysines / RMTs methylate histone arginines / DNAメチル化 / Condensation of Prophase Chromosomes / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / PRC2 methylates histones and DNA / Defective pyroptosis / HDACs deacetylate histones / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / NoRC negatively regulates rRNA expression / HDMs demethylate histones / B-WICH complex positively regulates rRNA expression / PKMTs methylate histone lysines / RMTs methylate histone arginines /  遺伝的組換え / Pre-NOTCH Transcription and Translation / 遺伝的組換え / Pre-NOTCH Transcription and Translation /  nucleosome assembly / Activation of anterior HOX genes in hindbrain development during early embryogenesis / HCMV Early Events / Transcriptional regulation of granulopoiesis / structural constituent of chromatin / transcription corepressor activity / nucleosome assembly / Activation of anterior HOX genes in hindbrain development during early embryogenesis / HCMV Early Events / Transcriptional regulation of granulopoiesis / structural constituent of chromatin / transcription corepressor activity /  ヌクレオソーム / RUNX1 regulates transcription of genes involved in differentiation of HSCs / ヌクレオソーム / RUNX1 regulates transcription of genes involved in differentiation of HSCs /  遺伝子発現 / chromatin organization / Factors involved in megakaryocyte development and platelet production / HATs acetylate histones / Senescence-Associated Secretory Phenotype (SASP) / 遺伝子発現 / chromatin organization / Factors involved in megakaryocyte development and platelet production / HATs acetylate histones / Senescence-Associated Secretory Phenotype (SASP) /  精子形成 / Oxidative Stress Induced Senescence / Estrogen-dependent gene expression / 精子形成 / Oxidative Stress Induced Senescence / Estrogen-dependent gene expression /  cadherin binding / protein heterodimerization activity / Amyloid fiber formation / protein-containing complex / cadherin binding / protein heterodimerization activity / Amyloid fiber formation / protein-containing complex /  DNA binding / extracellular exosome / extracellular region / DNA binding / extracellular exosome / extracellular region /  核質 / 核質 /  生体膜 / 生体膜 /  細胞核 細胞核類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.603 Å 分子置換 / 解像度: 1.603 Å | |||||||||
 データ登録者 データ登録者 | Qin, S. / Tempel, W. / Walker, J.R. / Arrowsmith, C.H. / Bountra, C. / Edwards, A.M. / Min, J. / Structural Genomics Consortium / Structural Genomics Consortium (SGC) | |||||||||
 引用 引用 |  ジャーナル: Cell Chem Biol / 年: 2020 ジャーナル: Cell Chem Biol / 年: 2020タイトル: Structural Basis for the Binding Selectivity of Human CDY Chromodomains. 著者: Dong, C. / Liu, Y. / Lyu, T.J. / Beldar, S. / Lamb, K.N. / Tempel, W. / Li, Y. / Li, Z. / James, L.I. / Qin, S. / Wang, Y. / Min, J. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6v41.cif.gz 6v41.cif.gz | 47.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6v41.ent.gz pdb6v41.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  6v41.json.gz 6v41.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/v4/6v41 https://data.pdbj.org/pub/pdb/validation_reports/v4/6v41 ftp://data.pdbj.org/pub/pdb/validation_reports/v4/6v41 ftp://data.pdbj.org/pub/pdb/validation_reports/v4/6v41 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  2mj8C 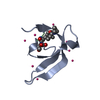 6v2dC  6v2hC  6v2rC  6v2sC  6v3nC  6v8wC  4haeS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 実験データセット #1 | データ参照:  10.18430/m36uhg / データの種類: diffraction image data 10.18430/m36uhg / データの種類: diffraction image data |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 7642.388 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: CDY1, CDY1A, CDY1B / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CDY1, CDY1A, CDY1B / 発現宿主:   Escherichia coli (大腸菌) Escherichia coli (大腸菌)参照: UniProt: Q9Y6F8,  ヒストンアセチルトランスフェラーゼ ヒストンアセチルトランスフェラーゼ | ||||
|---|---|---|---|---|---|
| #2: タンパク質・ペプチド | 分子量: 1607.877 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Homo sapiens (ヒト) / 参照: UniProt: P68431 Homo sapiens (ヒト) / 参照: UniProt: P68431 | ||||
| #3: 化合物 | ChemComp-UNX / #4: 水 | ChemComp-HOH / |  水 水研究の焦点であるリガンドがあるか | Y | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.81 Å3/Da / 溶媒含有率: 32.09 % |
|---|---|
結晶化 | 温度: 291 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.5 / 詳細: 1.4 M sodium citrate, 0.1 M HEPES |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU FR-E / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU FR-E / 波長: 1.5418 Å | ||||||||||||||||||||||||
| 検出器 | タイプ: RIGAKU SATURN A200 / 検出器: CCD / 日付: 2014年9月30日 | ||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 | ||||||||||||||||||||||||
| 反射 | 解像度: 1.6→23.36 Å / Num. obs: 8814 / % possible obs: 99.9 % / 冗長度: 7 % / CC1/2: 1 / Rmerge(I) obs: 0.028 / Rrim(I) all: 0.03 / Net I/σ(I): 43.4 | ||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: pdb entry 4hae 解像度: 1.603→23.301 Å / Cor.coef. Fo:Fc: 0.957 / Cor.coef. Fo:Fc free: 0.953 / SU B: 2.971 / SU ML: 0.055 / 交差検証法: FREE R-VALUE / ESU R: 0.104 / ESU R Free: 0.097 / 詳細: Hydrogens have been added in their riding positions
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 22.062 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.603→23.301 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 20 / % reflection obs: 100 %
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj











