| 登録情報 | データベース: PDB / ID: 6har
|
|---|
| タイトル | Crystal structure of Mesotrypsin in complex with APPI-M17C/I18F/F34C |
|---|
 要素 要素 | - Amyloid-beta A4 protein
- PRSS3 protein
|
|---|
 キーワード キーワード | PROTEIN FIBRIL / PRSS3 / Mesotrypsin / Serine protease / Kunitz type inhibitor / APPI |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
Golgi-associated vesicle / transition metal ion binding / trypsin / serine-type endopeptidase inhibitor activity / heparin binding / endosome / serine-type endopeptidase activity / proteolysis / metal ion binding / plasma membrane類似検索 - 分子機能 Pancreatic trypsin inhibitor Kunitz domain / Factor Xa Inhibitor / Amyloidogenic glycoprotein, copper-binding / Amyloidogenic glycoprotein, copper-binding domain conserved site / Amyloidogenic glycoprotein, copper-binding domain superfamily / Copper-binding of amyloid precursor, CuBD / Amyloid precursor protein (APP) copper-binding (CuBD) domain signature. / Amyloidogenic glycoprotein, extracellular / Amyloidogenic glycoprotein, heparin-binding / Amyloidogenic glycoprotein, E2 domain ...Pancreatic trypsin inhibitor Kunitz domain / Factor Xa Inhibitor / Amyloidogenic glycoprotein, copper-binding / Amyloidogenic glycoprotein, copper-binding domain conserved site / Amyloidogenic glycoprotein, copper-binding domain superfamily / Copper-binding of amyloid precursor, CuBD / Amyloid precursor protein (APP) copper-binding (CuBD) domain signature. / Amyloidogenic glycoprotein, extracellular / Amyloidogenic glycoprotein, heparin-binding / Amyloidogenic glycoprotein, E2 domain / E2 domain superfamily / Amyloidogenic glycoprotein, heparin-binding domain superfamily / Amyloid A4 N-terminal heparin-binding / E2 domain of amyloid precursor protein / Amyloid precursor protein (APP) E1 domain profile. / Amyloid precursor protein (APP) E2 domain profile. / amyloid A4 / Amyloidogenic glycoprotein / Proteinase inhibitor I2, Kunitz, conserved site / Pancreatic trypsin inhibitor (Kunitz) family signature. / BPTI/Kunitz family of serine protease inhibitors. / Pancreatic trypsin inhibitor Kunitz domain / Kunitz/Bovine pancreatic trypsin inhibitor domain / Pancreatic trypsin inhibitor (Kunitz) family profile. / Pancreatic trypsin inhibitor Kunitz domain superfamily / : / Few Secondary Structures / Irregular / Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin domain profile. / Trypsin-like serine protease / Serine proteases, trypsin domain / Trypsin / Trypsin-like serine proteases / Thrombin, subunit H / Peptidase S1, PA clan, chymotrypsin-like fold / Peptidase S1, PA clan / Beta Barrel / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.497 Å 分子置換 / 解像度: 1.497 Å |
|---|
 データ登録者 データ登録者 | Shahar, A. / Cohen, I. / Radisky, E. / Papo, N. |
|---|
| 資金援助 | 1件 | 組織 | 認可番号 | 国 |
|---|
| United States - Israel Binational Science Foundation (BSF) | 2015134 | |
|
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2019 ジャーナル: J.Biol.Chem. / 年: 2019
タイトル: Disulfide engineering of human Kunitz-type serine protease inhibitors enhances proteolytic stability and target affinity toward mesotrypsin.
著者: Cohen, I. / Coban, M. / Shahar, A. / Sankaran, B. / Hockla, A. / Lacham, S. / Caulfield, T.R. / Radisky, E.S. / Papo, N. |
|---|
| 履歴 | | 登録 | 2018年8月8日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2019年2月6日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2019年2月13日 | Group: Data collection / Database references
カテゴリ: citation / citation_author / pdbx_database_proc
Item: _citation.journal_abbrev / _citation.pdbx_database_id_PubMed ..._citation.journal_abbrev / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year / _citation_author.name |
|---|
| 改定 1.2 | 2019年4月10日 | Group: Data collection / Database references / カテゴリ: citation / pdbx_database_proc
Item: _citation.journal_abbrev / _citation.journal_volume ..._citation.journal_abbrev / _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.3 | 2022年3月30日 | Group: Author supporting evidence / Database references / カテゴリ: database_2 / pdbx_audit_support
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_audit_support.funding_organization |
|---|
| 改定 1.4 | 2024年1月17日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 1.5 | 2024年10月16日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.497 Å
分子置換 / 解像度: 1.497 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2019
ジャーナル: J.Biol.Chem. / 年: 2019 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6har.cif.gz
6har.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6har.ent.gz
pdb6har.ent.gz PDB形式
PDB形式 6har.json.gz
6har.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6har_validation.pdf.gz
6har_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6har_full_validation.pdf.gz
6har_full_validation.pdf.gz 6har_validation.xml.gz
6har_validation.xml.gz 6har_validation.cif.gz
6har_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ha/6har
https://data.pdbj.org/pub/pdb/validation_reports/ha/6har ftp://data.pdbj.org/pub/pdb/validation_reports/ha/6har
ftp://data.pdbj.org/pub/pdb/validation_reports/ha/6har リンク
リンク 集合体
集合体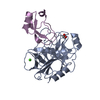
 要素
要素 Homo sapiens (ヒト) / 遺伝子: PRSS3 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PRSS3 / 発現宿主: 
 Homo sapiens (ヒト) / 遺伝子: APP / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: APP / 発現宿主:  Komagataella phaffii GS115 (菌類) / 参照: UniProt: H7C0V9
Komagataella phaffii GS115 (菌類) / 参照: UniProt: H7C0V9 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID30B / 波長: 0.97625 Å
/ ビームライン: ID30B / 波長: 0.97625 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー





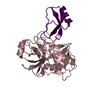









 PDBj
PDBj









