Entry Database : PDB / ID : 4u30Title Human mesotrypsin complexed with bikunin Kunitz domain 2 Keywords / / / / / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species Homo sapiens (human)Method / / Resolution : 2.5 Å Authors Wang, R. / Soares, A.S. / Radisky, E.S. Journal : J.Biol.Chem. / Year : 2014Title : Sequence and Conformational Specificity in Substrate Recognition: SEVERAL HUMAN KUNITZ PROTEASE INHIBITOR DOMAINS ARE SPECIFIC SUBSTRATES OF MESOTRYPSIN.Authors : Pendlebury, D. / Wang, R. / Henin, R.D. / Hockla, A. / Soares, A.S. / Madden, B.J. / Kazanov, M.D. / Radisky, E.S. History Deposition Jul 18, 2014 Deposition site / Processing site Revision 1.0 Oct 15, 2014 Provider / Type Revision 1.1 Nov 12, 2014 Group Revision 1.2 Dec 10, 2014 Group Revision 1.3 Jan 7, 2015 Group Revision 1.4 Dec 27, 2023 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Other / Refinement description / Source and taxonomy Category chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / citation / database_2 / entity_src_gen / pdbx_database_status / pdbx_struct_oper_list / refine_hist / struct_conn / struct_ref_seq_dif Item _citation.journal_id_CSD / _database_2.pdbx_DOI ... _citation.journal_id_CSD / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _entity_src_gen.pdbx_alt_source_flag / _pdbx_database_status.pdb_format_compatible / _pdbx_struct_oper_list.symmetry_operation / _refine_hist.number_atoms_solvent / _refine_hist.number_atoms_total / _refine_hist.pdbx_number_atoms_ligand / _refine_hist.pdbx_number_atoms_nucleic_acid / _refine_hist.pdbx_number_atoms_protein / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details Revision 1.5 Oct 23, 2024 Group / Category / pdbx_modification_feature
Show all Show less
 Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information Homo sapiens (human)
Homo sapiens (human) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON / Resolution: 2.5 Å
SYNCHROTRON / Resolution: 2.5 Å  Authors
Authors Citation
Citation Journal: J.Biol.Chem. / Year: 2014
Journal: J.Biol.Chem. / Year: 2014 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 4u30.cif.gz
4u30.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb4u30.ent.gz
pdb4u30.ent.gz PDB format
PDB format 4u30.json.gz
4u30.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/u3/4u30
https://data.pdbj.org/pub/pdb/validation_reports/u3/4u30 ftp://data.pdbj.org/pub/pdb/validation_reports/u3/4u30
ftp://data.pdbj.org/pub/pdb/validation_reports/u3/4u30 Links
Links Assembly
Assembly


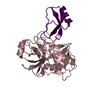

 Components
Components Homo sapiens (human) / Gene: PRSS3, PRSS4, TRY3, TRY4 / Production host:
Homo sapiens (human) / Gene: PRSS3, PRSS4, TRY3, TRY4 / Production host: 
 Homo sapiens (human) / Gene: AMBP, HCP, ITIL / Production host:
Homo sapiens (human) / Gene: AMBP, HCP, ITIL / Production host:  Komagataella pastoris (fungus) / References: UniProt: P02760
Komagataella pastoris (fungus) / References: UniProt: P02760 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Type: OTHER / Wavelength: 1.075 Å
SYNCHROTRON / Type: OTHER / Wavelength: 1.075 Å Processing
Processing Movie
Movie Controller
Controller














 PDBj
PDBj






















