Entry Database : PDB / ID : 3l33Title Human mesotrypsin complexed with amyloid precursor protein inhibitor(APPI) Amyloid beta A4 protein Trypsin-3 Keywords / / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species Homo sapiens (human)Method / / / / Resolution : 2.48 Å Authors Salameh, M.A. / Soares, A.S. / Radisky, E.S. Journal : J.Biol.Chem. / Year : 2010Title : Determinants of affinity and proteolytic stability in interactions of Kunitz family protease inhibitors with mesotrypsin.Authors : Salameh, M.A. / Soares, A.S. / Navaneetham, D. / Sinha, D. / Walsh, P.N. / Radisky, E.S. History Deposition Dec 16, 2009 Deposition site / Processing site Revision 1.0 Sep 22, 2010 Provider / Type Revision 1.1 Jul 13, 2011 Group Revision 1.2 Oct 16, 2024 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Structure summary Category chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_asym_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
Show all Show less
 Yorodumi
Yorodumi Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information Homo sapiens (human)
Homo sapiens (human) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT /
MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 2.48 Å
molecular replacement / Resolution: 2.48 Å  Authors
Authors Citation
Citation Journal: J.Biol.Chem. / Year: 2010
Journal: J.Biol.Chem. / Year: 2010 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 3l33.cif.gz
3l33.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb3l33.ent.gz
pdb3l33.ent.gz PDB format
PDB format 3l33.json.gz
3l33.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads 3l33_validation.pdf.gz
3l33_validation.pdf.gz wwPDB validaton report
wwPDB validaton report 3l33_full_validation.pdf.gz
3l33_full_validation.pdf.gz 3l33_validation.xml.gz
3l33_validation.xml.gz 3l33_validation.cif.gz
3l33_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/l3/3l33
https://data.pdbj.org/pub/pdb/validation_reports/l3/3l33 ftp://data.pdbj.org/pub/pdb/validation_reports/l3/3l33
ftp://data.pdbj.org/pub/pdb/validation_reports/l3/3l33 Links
Links Assembly
Assembly
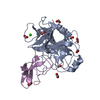



 Components
Components Homo sapiens (human) / Strain: BL21(DE3) / Gene: PRSS3, PRSS4, TRY3, TRY4 / Production host:
Homo sapiens (human) / Strain: BL21(DE3) / Gene: PRSS3, PRSS4, TRY3, TRY4 / Production host: 
 Homo sapiens (human) / Gene: APP, A4, AD1 / Production host:
Homo sapiens (human) / Gene: APP, A4, AD1 / Production host:  Pichia pastoris (fungus) / References: UniProt: P05067
Pichia pastoris (fungus) / References: UniProt: P05067 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  NSLS
NSLS  / Beamline: X12B
/ Beamline: X12B molecular replacement
molecular replacement Processing
Processing MOLECULAR REPLACEMENT / Resolution: 2.48→23.702 Å / Occupancy max: 1 / Occupancy min: 0 / FOM work R set: 0.843 / Stereochemistry target values: mlhl
MOLECULAR REPLACEMENT / Resolution: 2.48→23.702 Å / Occupancy max: 1 / Occupancy min: 0 / FOM work R set: 0.843 / Stereochemistry target values: mlhl Movie
Movie Controller
Controller















 PDBj
PDBj
























