Entry Database : PDB / ID : 2vwfTitle Grb2 SH3C (2) GRB2-ASSOCIATED-BINDING PROTEIN 2 GROWTH FACTOR RECEPTOR-BOUND PROTEIN 2 Keywords / / / / / / / / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species HOMO SAPIENS (human)Method / / / Resolution : 1.58 Å Authors Harkiolaki, M. / Tsirka, T. / Feller, S.M. Journal : Structure / Year : 2009Title : Distinct Binding Modes of Two Epitopes in Gab2 that Interact with the Sh3C Domain of Grb2.Authors : Harkiolaki, M. / Tsirka, T. / Lewitzky, M. / Simister, P.C. / Joshi, D. / Bird, L.E. / Jones, E.Y. / O'Reilly, N. / Feller, S.M. History Deposition Jun 24, 2008 Deposition site / Processing site Revision 1.0 May 19, 2009 Provider / Type Revision 1.1 May 8, 2011 Group Revision 1.2 Jul 13, 2011 Group Revision 1.3 Dec 13, 2023 Group Data collection / Database references ... Data collection / Database references / Other / Refinement description Category chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_initial_refinement_model Item / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf
Show all Show less
 Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information HOMO SAPIENS (human)
HOMO SAPIENS (human) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.58 Å
MOLECULAR REPLACEMENT / Resolution: 1.58 Å  Authors
Authors Citation
Citation Journal: Structure / Year: 2009
Journal: Structure / Year: 2009 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 2vwf.cif.gz
2vwf.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb2vwf.ent.gz
pdb2vwf.ent.gz PDB format
PDB format 2vwf.json.gz
2vwf.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/vw/2vwf
https://data.pdbj.org/pub/pdb/validation_reports/vw/2vwf ftp://data.pdbj.org/pub/pdb/validation_reports/vw/2vwf
ftp://data.pdbj.org/pub/pdb/validation_reports/vw/2vwf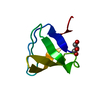

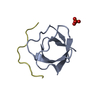
 Links
Links Assembly
Assembly
 Components
Components HOMO SAPIENS (human) / Plasmid: OPIN J / Production host:
HOMO SAPIENS (human) / Plasmid: OPIN J / Production host: 
 HOMO SAPIENS (human) / References: UniProt: Q9UQC2
HOMO SAPIENS (human) / References: UniProt: Q9UQC2 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  ESRF
ESRF  / Beamline: BM14 / Wavelength: 0.9537
/ Beamline: BM14 / Wavelength: 0.9537  Processing
Processing MOLECULAR REPLACEMENT
MOLECULAR REPLACEMENT Movie
Movie Controller
Controller























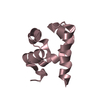





 PDBj
PDBj























