[English] 日本語
 Yorodumi
Yorodumi- PDB-2tsy: CRYSTAL STRUCTURES OF MUTANT (BETAK87T) TRYPTOPHAN SYNTHASE ALPHA... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2tsy | ||||||
|---|---|---|---|---|---|---|---|
| Title | CRYSTAL STRUCTURES OF MUTANT (BETAK87T) TRYPTOPHAN SYNTHASE ALPHA2 BETA2 COMPLEX WITH LIGANDS BOUND TO THE ACTIVE SITES OF THE ALPHA AND BETA SUBUNITS REVEAL LIGAND-INDUCED CONFORMATIONAL CHANGES | ||||||
 Components Components | (TRYPTOPHAN SYNTHASE) x 2 | ||||||
 Keywords Keywords | LYASE / CARBON-OXYGEN LYASE / TRYPTOPHAN BIOSYNTHESIS / PYRIDOXAL PHOSPHATE | ||||||
| Function / homology |  Function and homology information Function and homology informationtryptophan synthase / tryptophan synthase activity / L-tryptophan biosynthetic process / identical protein binding / cytoplasm / cytosol Similarity search - Function | ||||||
| Biological species |  Salmonella typhimurium (bacteria) Salmonella typhimurium (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / ISOMORPHOUS WITH PDB ENTRY 1WSY. / Resolution: 2.5 Å X-RAY DIFFRACTION / ISOMORPHOUS WITH PDB ENTRY 1WSY. / Resolution: 2.5 Å | ||||||
 Authors Authors | Rhee, S. / Parris, K.D. / Hyde, C.C. / Ahmed, S.A. / Miles, E.W. / Davies, D.R. | ||||||
 Citation Citation |  Journal: Biochemistry / Year: 1997 Journal: Biochemistry / Year: 1997Title: Crystal structures of a mutant (betaK87T) tryptophan synthase alpha2beta2 complex with ligands bound to the active sites of the alpha- and beta-subunits reveal ligand-induced conformational changes. Authors: Rhee, S. / Parris, K.D. / Hyde, C.C. / Ahmed, S.A. / Miles, E.W. / Davies, D.R. #1:  Journal: J.Biol.Chem. / Year: 1993 Journal: J.Biol.Chem. / Year: 1993Title: Lysine 87 in the Beta Subunit of Tryptophan Synthase that Forms an Internal Aldimine with Pyridoxal Phosphate Serves Critical Roles in Transimination, Catalysis, and Product Release Authors: Lu, Z. / Nagata, S. / Mcphie, P. / Miles, E.W. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2tsy.cif.gz 2tsy.cif.gz | 138 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2tsy.ent.gz pdb2tsy.ent.gz | 107.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2tsy.json.gz 2tsy.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ts/2tsy https://data.pdbj.org/pub/pdb/validation_reports/ts/2tsy ftp://data.pdbj.org/pub/pdb/validation_reports/ts/2tsy ftp://data.pdbj.org/pub/pdb/validation_reports/ts/2tsy | HTTPS FTP |
|---|
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 2 types, 2 molecules AB
| #1: Protein | Mass: 28698.797 Da / Num. of mol.: 1 / Mutation: CHAIN B, K87T Source method: isolated from a genetically manipulated source Details: LIGAND GLYCEROL-3-PHOSPHATE BOUND TO THE ALPHA SUBUNIT AND L-SERINE BOUND TO THE BETA SUBUNIT Source: (gene. exp.)  Salmonella typhimurium (bacteria) / Cell line: CB149 / Gene: TRPA/TRPB / Plasmid: PSTB7 / Cell line (production host): CB149 / Gene (production host): TRPA/TRPB / Production host: Salmonella typhimurium (bacteria) / Cell line: CB149 / Gene: TRPA/TRPB / Plasmid: PSTB7 / Cell line (production host): CB149 / Gene (production host): TRPA/TRPB / Production host:  |
|---|---|
| #2: Protein | Mass: 42944.965 Da / Num. of mol.: 1 / Mutation: CHAIN B, K87T Source method: isolated from a genetically manipulated source Details: LIGAND GLYCEROL-3-PHOSPHATE BOUND TO THE ALPHA SUBUNIT AND L-SERINE BOUND TO THE BETA SUBUNIT Source: (gene. exp.)  Salmonella typhimurium (bacteria) / Cell line: CB149 / Gene: TRPA/TRPB / Plasmid: PSTB7 / Cell line (production host): CB149 / Gene (production host): TRPA/TRPB / Production host: Salmonella typhimurium (bacteria) / Cell line: CB149 / Gene: TRPA/TRPB / Plasmid: PSTB7 / Cell line (production host): CB149 / Gene (production host): TRPA/TRPB / Production host:  |
-Non-polymers , 4 types, 128 molecules 

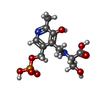




| #3: Chemical | ChemComp-G3P / |
|---|---|
| #4: Chemical | ChemComp-NA / |
| #5: Chemical | ChemComp-PLS / [ |
| #6: Water | ChemComp-HOH / |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 2 X-RAY DIFFRACTION / Number of used crystals: 2 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.4 Å3/Da / Density % sol: 48 % | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | pH: 7.8 Details: 50MM NABICINE (PH 7.8), 1MM NA-EDTA, 0.8-1.5MM SPERMINE, 12% PEG8000 | |||||||||||||||||||||||||
| Crystal grow | *PLUS Method: unknown / Details: pH is adjusted to 7.8 with NaOH | |||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Diffraction | Mean temperature: 298 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU RUH2R / Wavelength: 1.5418 ROTATING ANODE / Type: RIGAKU RUH2R / Wavelength: 1.5418 |
| Detector | Type: RIGAKU RAXIS IIC / Detector: IMAGE PLATE / Date: Dec 1, 1992 |
| Radiation | Monochromator: NI FILTER / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 |
| Reflection | Highest resolution: 2.5 Å / Num. obs: 24203 / % possible obs: 91.7 % / Observed criterion σ(I): 2 / Biso Wilson estimate: 38.1 Å2 / Rsym value: 0.089 / Net I/σ(I): 11.6 |
| Reflection shell | Resolution: 2.5→2.6 Å / Mean I/σ(I) obs: 4 / % possible all: 82.6 |
| Reflection | *PLUS Rmerge(I) obs: 0.089 |
| Reflection shell | *PLUS % possible obs: 82.6 % |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure: ISOMORPHOUS WITH PDB ENTRY 1WSY. Resolution: 2.5→8 Å / Data cutoff high absF: 100000 / Data cutoff low absF: 0.1 / σ(F): 2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 40 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.31 Å / Luzzati d res low obs: 8 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.5→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.5→2.61 Å / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Software | *PLUS Name:  X-PLOR / Classification: refinement X-PLOR / Classification: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement | *PLUS Rfactor Rfree: 0.278 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | *PLUS Rfactor obs: 0.302 |
 Movie
Movie Controller
Controller

























 PDBj
PDBj



