+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4763 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of NCP_THF2(-1)-UV-DDB | ||||||||||||||||||||||||
 マップデータ マップデータ | |||||||||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||||||||
 キーワード キーワード | DNA damage / Nucleosome / THF2 photoproduct / DNA BINDING PROTEIN | ||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation by virus of viral protein levels in host cell / spindle assembly involved in female meiosis / epigenetic programming in the zygotic pronuclei / UV-damage excision repair / biological process involved in interaction with symbiont / regulation of mitotic cell cycle phase transition / WD40-repeat domain binding / Cul4A-RING E3 ubiquitin ligase complex / Cul4-RING E3 ubiquitin ligase complex / Cul4B-RING E3 ubiquitin ligase complex ...positive regulation by virus of viral protein levels in host cell / spindle assembly involved in female meiosis / epigenetic programming in the zygotic pronuclei / UV-damage excision repair / biological process involved in interaction with symbiont / regulation of mitotic cell cycle phase transition / WD40-repeat domain binding / Cul4A-RING E3 ubiquitin ligase complex / Cul4-RING E3 ubiquitin ligase complex / Cul4B-RING E3 ubiquitin ligase complex / ubiquitin ligase complex scaffold activity / negative regulation of reproductive process / negative regulation of developmental process / cullin family protein binding / viral release from host cell / site of DNA damage / pyrimidine dimer repair / negative regulation of tumor necrosis factor-mediated signaling pathway / ectopic germ cell programmed cell death / positive regulation of viral genome replication / response to UV / negative regulation of megakaryocyte differentiation / protein autoubiquitination / protein localization to CENP-A containing chromatin / proteasomal protein catabolic process / Chromatin modifying enzymes / Replacement of protamines by nucleosomes in the male pronucleus / CENP-A containing nucleosome / Packaging Of Telomere Ends / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / positive regulation of gluconeogenesis / Deposition of new CENPA-containing nucleosomes at the centromere / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / telomere organization / Interleukin-7 signaling / RNA Polymerase I Promoter Opening / Inhibition of DNA recombination at telomere / epigenetic regulation of gene expression / Meiotic synapsis / Assembly of the ORC complex at the origin of replication / SUMOylation of chromatin organization proteins / Regulation of endogenous retroelements by the Human Silencing Hub (HUSH) complex / DNA methylation / Condensation of Prophase Chromosomes / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / innate immune response in mucosa / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / PRC2 methylates histones and DNA / Regulation of endogenous retroelements by KRAB-ZFP proteins / Defective pyroptosis / nucleotide-excision repair / TP53 Regulates Transcription of DNA Repair Genes / HDACs deacetylate histones / Regulation of endogenous retroelements by Piwi-interacting RNAs (piRNAs) / Nonhomologous End-Joining (NHEJ) / RNA Polymerase I Promoter Escape / lipopolysaccharide binding / Transcriptional regulation by small RNAs / Recognition of DNA damage by PCNA-containing replication complex / Formation of the beta-catenin:TCF transactivating complex / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / HDMs demethylate histones / regulation of circadian rhythm / G2/M DNA damage checkpoint / DNA Damage Recognition in GG-NER / NoRC negatively regulates rRNA expression / B-WICH complex positively regulates rRNA expression / DNA Damage/Telomere Stress Induced Senescence / PKMTs methylate histone lysines / Dual Incision in GG-NER / Meiotic recombination / Pre-NOTCH Transcription and Translation / Transcription-Coupled Nucleotide Excision Repair (TC-NER) / Formation of TC-NER Pre-Incision Complex / Metalloprotease DUBs / Formation of Incision Complex in GG-NER / RMTs methylate histone arginines / Activation of anterior HOX genes in hindbrain development during early embryogenesis / Wnt signaling pathway / Transcriptional regulation of granulopoiesis / protein polyubiquitination / HCMV Early Events / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / antimicrobial humoral immune response mediated by antimicrobial peptide / positive regulation of protein catabolic process / cellular response to UV / structural constituent of chromatin / UCH proteinases / cell junction / antibacterial humoral response / rhythmic process / nucleosome / heterochromatin formation / nucleosome assembly 類似検索 - 分子機能 | ||||||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.9 Å | ||||||||||||||||||||||||
 データ登録者 データ登録者 | Matsumoto S / Cavadini S | ||||||||||||||||||||||||
| 資金援助 |  スイス, スイス,  日本, 7件 日本, 7件
| ||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2019 ジャーナル: Nature / 年: 2019タイトル: DNA damage detection in nucleosomes involves DNA register shifting. 著者: Syota Matsumoto / Simone Cavadini / Richard D Bunker / Ralph S Grand / Alessandro Potenza / Julius Rabl / Junpei Yamamoto / Andreas D Schenk / Dirk Schübeler / Shigenori Iwai / Kaoru ...著者: Syota Matsumoto / Simone Cavadini / Richard D Bunker / Ralph S Grand / Alessandro Potenza / Julius Rabl / Junpei Yamamoto / Andreas D Schenk / Dirk Schübeler / Shigenori Iwai / Kaoru Sugasawa / Hitoshi Kurumizaka / Nicolas H Thomä /   要旨: Access to DNA packaged in nucleosomes is critical for gene regulation, DNA replication and DNA repair. In humans, the UV-damaged DNA-binding protein (UV-DDB) complex detects UV-light-induced ...Access to DNA packaged in nucleosomes is critical for gene regulation, DNA replication and DNA repair. In humans, the UV-damaged DNA-binding protein (UV-DDB) complex detects UV-light-induced pyrimidine dimers throughout the genome; however, it remains unknown how these lesions are recognized in chromatin, in which nucleosomes restrict access to DNA. Here we report cryo-electron microscopy structures of UV-DDB bound to nucleosomes bearing a 6-4 pyrimidine-pyrimidone dimer or a DNA-damage mimic in various positions. We find that UV-DDB binds UV-damaged nucleosomes at lesions located in the solvent-facing minor groove without affecting the overall nucleosome architecture. In the case of buried lesions that face the histone core, UV-DDB changes the predominant translational register of the nucleosome and selectively binds the lesion in an accessible, exposed position. Our findings explain how UV-DDB detects occluded lesions in strongly positioned nucleosomes, and identify slide-assisted site exposure as a mechanism by which high-affinity DNA-binding proteins can access otherwise occluded sites in nucleosomal DNA. | ||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4763.map.gz emd_4763.map.gz | 76.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4763-v30.xml emd-4763-v30.xml emd-4763.xml emd-4763.xml | 29.5 KB 29.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_4763.png emd_4763.png | 146.9 KB | ||
| Filedesc metadata |  emd-4763.cif.gz emd-4763.cif.gz | 8.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4763 http://ftp.pdbj.org/pub/emdb/structures/EMD-4763 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4763 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4763 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6r8zMC  4762C  4764C  4765C  4766C  4767C  4768C  6r8yC  6r90C  6r91C  6r92C  6r93C  6r94C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4763.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4763.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
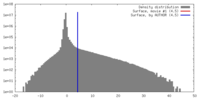
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
+全体 : UV-DDB bound to a THF2 containing nucleosome
+超分子 #1: UV-DDB bound to a THF2 containing nucleosome
+超分子 #2: Histone H3.1, Histone H2A, Histone H2B
+超分子 #3: Histone H4
+超分子 #4: DNA
+超分子 #5: DNA damage-binding protein 1(2), DNA damage-binding protein 2
+分子 #1: Histone H3.1
+分子 #2: Histone H4
+分子 #3: Histone H2A type 1-B/E
+分子 #4: Histone H2B type 1-J
+分子 #7: DNA damage-binding protein 1
+分子 #8: DNA damage-binding protein 2
+分子 #5: Human alpha-satellite DNA (145-MER)
+分子 #6: Human alpha-satellite DNA (145-MER) with abasic sites at position...
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 85 % / チャンバー内温度: 277 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 0.0 mm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 2) / 使用した粒子像数: 129986 |
| 初期 角度割当 | タイプ: OTHER / ソフトウェア - 名称: RELION |
| 最終 角度割当 | タイプ: OTHER / ソフトウェア - 名称: RELION |
-原子モデル構築 1
| 初期モデル |
| ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT 当てはまり具合の基準: Cross-correlation coefficient | ||||||||||||||||||||||||||
| 得られたモデル |  PDB-6r8z: |
 ムービー
ムービー コントローラー
コントローラー





























 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)




















 Trichoplusia ni (イラクサキンウワバ)
Trichoplusia ni (イラクサキンウワバ)



