+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4169 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | N terminal region of dynein tail domains in complex with dynactin filament and BICDR-1 | |||||||||
 マップデータ マップデータ | Map of the N-terminal half of two dynein tail domains bound to dynactin and BICDR1. This map was generated after particle signal subtraction from the overall map (separate deposition) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Cryo-EM / Complex / MOTOR PROTEIN / Cargo adaptor | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Golgi to secretory granule transport / RHOD GTPase cycle / Factors involved in megakaryocyte development and platelet production / RHOF GTPase cycle / Regulation of PLK1 Activity at G2/M Transition / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / dynactin complex ...Golgi to secretory granule transport / RHOD GTPase cycle / Factors involved in megakaryocyte development and platelet production / RHOF GTPase cycle / Regulation of PLK1 Activity at G2/M Transition / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / dynactin complex / Recruitment of mitotic centrosome proteins and complexes / transport along microtubule / F-actin capping protein complex / WASH complex / dynein light chain binding / dynein heavy chain binding / positive regulation of intracellular transport / regulation of metaphase plate congression / establishment of spindle localization / positive regulation of spindle assembly / barbed-end actin filament capping / dynein complex / regulation of cell morphogenesis / COPI-independent Golgi-to-ER retrograde traffic / retrograde axonal transport / minus-end-directed microtubule motor activity / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / MHC class II antigen presentation / P-body assembly / Recruitment of NuMA to mitotic centrosomes / dynein light intermediate chain binding / microtubule motor activity / cytoplasmic dynein complex / COPI-mediated anterograde transport / dynein intermediate chain binding / nuclear migration / microtubule-based movement / cortical cytoskeleton / dynactin binding / microtubule-based process / cytoplasmic microtubule / COPI-mediated anterograde transport / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / cytoplasmic microtubule organization / axon cytoplasm / cytoskeleton organization / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / stress granule assembly / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / MHC class II antigen presentation / Recruitment of NuMA to mitotic centrosomes / regulation of mitotic spindle organization / Anchoring of the basal body to the plasma membrane / Resolution of Sister Chromatid Cohesion / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / AURKA Activation by TPX2 / sarcomere / mitotic spindle organization / filopodium / RHO GTPases Activate Formins / small GTPase binding / HCMV Early Events / Aggrephagy / neuron projection development / actin filament binding / Separation of Sister Chromatids / azurophil granule lumen / Regulation of PLK1 Activity at G2/M Transition / positive regulation of cold-induced thermogenesis / actin binding / actin cytoskeleton organization / cell cortex / vesicle / microtubule / cell division / centrosome / Neutrophil degranulation / ATP hydrolysis activity / RNA binding / extracellular exosome / extracellular region / ATP binding / identical protein binding / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Urnavicius L / Lau CK | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2018 ジャーナル: Nature / 年: 2018タイトル: Cryo-EM shows how dynactin recruits two dyneins for faster movement. 著者: Linas Urnavicius / Clinton K Lau / Mohamed M Elshenawy / Edgar Morales-Rios / Carina Motz / Ahmet Yildiz / Andrew P Carter /    要旨: Dynein and its cofactor dynactin form a highly processive microtubule motor in the presence of an activating adaptor, such as BICD2. Different adaptors link dynein and dynactin to distinct cargoes. ...Dynein and its cofactor dynactin form a highly processive microtubule motor in the presence of an activating adaptor, such as BICD2. Different adaptors link dynein and dynactin to distinct cargoes. Here we use electron microscopy and single-molecule studies to show that adaptors can recruit a second dynein to dynactin. Whereas BICD2 is biased towards recruiting a single dynein, the adaptors BICDR1 and HOOK3 predominantly recruit two dyneins. We find that the shift towards a double dynein complex increases both the force and speed of the microtubule motor. Our 3.5 Å resolution cryo-electron microscopy reconstruction of a dynein tail-dynactin-BICDR1 complex reveals how dynactin can act as a scaffold to coordinate two dyneins side-by-side. Our work provides a structural basis for understanding how diverse adaptors recruit different numbers of dyneins and regulate the motile properties of the dynein-dynactin transport machine. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4169.map.gz emd_4169.map.gz | 288.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4169-v30.xml emd-4169-v30.xml emd-4169.xml emd-4169.xml | 31.3 KB 31.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_4169.png emd_4169.png | 139 KB | ||
| Filedesc metadata |  emd-4169.cif.gz emd-4169.cif.gz | 9.2 KB | ||
| その他 |  emd_4169_additional_1.map.gz emd_4169_additional_1.map.gz emd_4169_additional_2.map.gz emd_4169_additional_2.map.gz | 1 MB 1.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4169 http://ftp.pdbj.org/pub/emdb/structures/EMD-4169 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4169 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4169 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6f1uMC  4168C  4170C  4171C  4172C  4177C  5owoC  6f1tC  6f1vC  6f1yC  6f1zC  6f38C  6f3aC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4169.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4169.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map of the N-terminal half of two dynein tail domains bound to dynactin and BICDR1. This map was generated after particle signal subtraction from the overall map (separate deposition) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.34 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
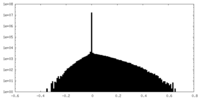
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: Map of summed signal of dynein heavy chains present in main map
| ファイル | emd_4169_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map of summed signal of dynein heavy chains present in main map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Map of summed signal of dynein intermediate chains...
| ファイル | emd_4169_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map of summed signal of dynein intermediate chains present in main map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Two dynein tail domains bound to dynactin and BICDR1.
+超分子 #1: Two dynein tail domains bound to dynactin and BICDR1.
+超分子 #2: dynactin filament
+超分子 #3: Cytoplasmic dynein
+超分子 #4: BICDR1
+分子 #1: ARP1 actin related protein 1 homolog A
+分子 #2: Capping protein (Actin filament) muscle Z-line, alpha 1
+分子 #3: F-actin capping protein beta subunit
+分子 #4: Dynactin subunit 2
+分子 #5: Dynactin subunit 2
+分子 #6: Cytoplasmic dynein 1 heavy chain 1
+分子 #7: Cytoplasmic dynein 1 intermediate chain 2
+分子 #8: BICD family-like cargo adapter 1
+分子 #9: ADENOSINE-5'-DIPHOSPHATE
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: 詳細: Initial model low pass filtered to 50 A |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION / 使用した粒子像数: 205611 |
| 初期 角度割当 | タイプ: PROJECTION MATCHING / ソフトウェア - 名称: RELION |
| 最終 角度割当 | タイプ: PROJECTION MATCHING / ソフトウェア - 名称: RELION 詳細: Particle signal subtraction of areas outside this region, followed by refinement and 3D classification |
-原子モデル構築 1
| 精密化 | 空間: REAL 当てはまり具合の基準: Cross-correlation coefficient |
|---|---|
| 得られたモデル |  PDB-6f1u: |
 ムービー
ムービー コントローラー
コントローラー
































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)