+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6zs5 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
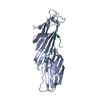
| Title | 3.5 A cryo-EM structure of human uromodulin filament core | |||||||||||||||
 Components Components | Uromodulin | |||||||||||||||
 Keywords Keywords | ANTIMICROBIAL PROTEIN / Uromodulin / Umod / THP / immunoglobulin-like fold / Tamm-Horsfall protein / glycoprotein / ZP module / Zona Pellucida / fold complementation / beta-strand complementation / cryoSPARC / filament / soluble adhesion antagonist | |||||||||||||||
| Function / homology |  Function and homology information Function and homology informationcitric acid secretion / metanephric thick ascending limb development / micturition / metanephric distal convoluted tubule development / connective tissue replacement / protein transport into plasma membrane raft / Asparagine N-linked glycosylation / organ or tissue specific immune response / collecting duct development / urea transmembrane transport ...citric acid secretion / metanephric thick ascending limb development / micturition / metanephric distal convoluted tubule development / connective tissue replacement / protein transport into plasma membrane raft / Asparagine N-linked glycosylation / organ or tissue specific immune response / collecting duct development / urea transmembrane transport / metanephric ascending thin limb development / protein localization to vacuole / regulation of protein transport / juxtaglomerular apparatus development / antibacterial innate immune response / intracellular chloride ion homeostasis / renal urate salt excretion / glomerular filtration / urate transport / renal sodium ion absorption / neutrophil migration / response to water deprivation / intracellular phosphate ion homeostasis / potassium ion homeostasis / regulation of urine volume / intracellular sodium ion homeostasis / endoplasmic reticulum organization / IgG binding / heterophilic cell-cell adhesion / extrinsic component of membrane / ciliary membrane / leukocyte cell-cell adhesion / cellular response to unfolded protein / cellular defense response / multicellular organismal response to stress / renal water homeostasis / side of membrane / : / ERAD pathway / RNA splicing / tumor necrosis factor-mediated signaling pathway / apoptotic signaling pathway / autophagy / Golgi lumen / lipid metabolic process / regulation of blood pressure / intracellular calcium ion homeostasis / spindle pole / response to lipopolysaccharide / defense response to Gram-negative bacterium / basolateral plasma membrane / cilium / apical plasma membrane / response to xenobiotic stimulus / inflammatory response / negative regulation of cell population proliferation / calcium ion binding / cell surface / endoplasmic reticulum / extracellular space / extracellular exosome / membrane Similarity search - Function | |||||||||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.5 Å | |||||||||||||||
 Authors Authors | Stanisich, J.J. / Zyla, D. / Afanasyev, P. / Xu, J. / Pilhofer, M. / Boeringer, D. / Glockshuber, R. | |||||||||||||||
| Funding support |  Switzerland, 4items Switzerland, 4items
| |||||||||||||||
 Citation Citation |  Journal: Elife / Year: 2020 Journal: Elife / Year: 2020Title: The cryo-EM structure of the human uromodulin filament core reveals a unique assembly mechanism. Authors: Jessica J Stanisich / Dawid S Zyla / Pavel Afanasyev / Jingwei Xu / Anne Kipp / Eric Olinger / Olivier Devuyst / Martin Pilhofer / Daniel Boehringer / Rudi Glockshuber /    Abstract: The glycoprotein uromodulin (UMOD) is the most abundant protein in human urine and forms filamentous homopolymers that encapsulate and aggregate uropathogens, promoting pathogen clearance by urine ...The glycoprotein uromodulin (UMOD) is the most abundant protein in human urine and forms filamentous homopolymers that encapsulate and aggregate uropathogens, promoting pathogen clearance by urine excretion. Despite its critical role in the innate immune response against urinary tract infections, the structural basis and mechanism of UMOD polymerization remained unknown. Here, we present the cryo-EM structure of the UMOD filament core at 3.5 Å resolution, comprised of the bipartite zona pellucida (ZP) module in a helical arrangement with a rise of ~65 Å and a twist of ~180°. The immunoglobulin-like ZPN and ZPC subdomains of each monomer are separated by a long linker that interacts with the preceding ZPC and following ZPN subdomains by β-sheet complementation. The unique filament architecture suggests an assembly mechanism in which subunit incorporation could be synchronized with proteolytic cleavage of the C-terminal pro-peptide that anchors assembly-incompetent UMOD precursors to the membrane. | |||||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6zs5.cif.gz 6zs5.cif.gz | 77.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6zs5.ent.gz pdb6zs5.ent.gz | 46.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6zs5.json.gz 6zs5.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/zs/6zs5 https://data.pdbj.org/pub/pdb/validation_reports/zs/6zs5 ftp://data.pdbj.org/pub/pdb/validation_reports/zs/6zs5 ftp://data.pdbj.org/pub/pdb/validation_reports/zs/6zs5 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  11388MC  6zyaC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
| #1: Protein | Mass: 69821.680 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  Homo sapiens (human) / References: UniProt: P07911 Homo sapiens (human) / References: UniProt: P07911#2: Polysaccharide | alpha-D-mannopyranose-(1-3)-[alpha-D-mannopyranose-(1-6)]beta-D-mannopyranose-(1-4)-2-acetamido-2- ...alpha-D-mannopyranose-(1-3)-[alpha-D-mannopyranose-(1-6)]beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose | Source method: isolated from a genetically manipulated source #3: Polysaccharide | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose | Source method: isolated from a genetically manipulated source Has ligand of interest | N | Has protein modification | Y | |
|---|
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: FILAMENT / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Native human uromodulin filament core / Type: COMPLEX Details: Native uromodulin was purified from healthy human urine. Entity ID: #1 / Source: NATURAL |
|---|---|
| Molecular weight | Value: 1.28 kDa/nm / Experimental value: YES |
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Source (recombinant) | Organism:  |
| Buffer solution | pH: 8.2 |
| Buffer component | Conc.: 0.5 mM / Name: Ethylenediaminetetraacetic acid / Formula: EDTA |
| Specimen | Conc.: 1.58 mg/ml / Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES / Details: individual, isolated fibers |
| Specimen support | Grid material: COPPER / Grid mesh size: 400 divisions/in. / Grid type: Homemade |
| Vitrification | Instrument: FEI VITROBOT MARK IV / Cryogen name: ETHANE-PROPANE / Humidity: 95 % / Chamber temperature: 282 K Details: 3.5 ul sample, 30 s wait time, 0.5 s drain time, 13.5 s blotting from the back |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TITAN KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal magnification: 130000 X / Nominal defocus max: 3300 nm / Nominal defocus min: 800 nm / Cs: 2.7 mm / C2 aperture diameter: 100 µm / Alignment procedure: COMA FREE |
| Specimen holder | Cryogen: NITROGEN / Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER |
| Image recording | Average exposure time: 6 sec. / Electron dose: 45 e/Å2 / Detector mode: COUNTING / Film or detector model: GATAN K2 SUMMIT (4k x 4k) / Num. of grids imaged: 2 / Num. of real images: 9543 / Details: Data was joined from two sessions |
| Image scans | Width: 3838 / Height: 3710 / Movie frames/image: 40 |
- Processing
Processing
| EM software |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Image processing | Details: Motion correction with dose-weighting | ||||||||||||||||||||||||||||||||||||||||
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| Particle selection | Num. of particles selected: 1310000 Details: Autopicking based on the 2D classes from manually chosen filaments | ||||||||||||||||||||||||||||||||||||||||
| 3D reconstruction | Resolution: 3.5 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 145000 / Symmetry type: POINT | ||||||||||||||||||||||||||||||||||||||||
| Atomic model building | B value: 49.9714 / Protocol: RIGID BODY FIT / Space: REAL / Target criteria: Correlation coefficient | ||||||||||||||||||||||||||||||||||||||||
| Atomic model building | PDB-ID: 4WRN Pdb chain-ID: A / Accession code: 4WRN / Pdb chain residue range: 400-710 / Source name: PDB / Type: experimental model |
 Movie
Movie Controller
Controller













 PDBj
PDBj





