| 登録情報 | データベース: PDB / ID: 4z0x
|
|---|
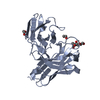
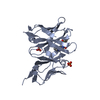
| タイトル | Structure of Hepatitis C Virus Envelope glycoprotein E2 antigenic region 434-446 bound to the broadly neutralizing antibody HC26AM |
|---|
 要素 要素 | - Antibody HC26AM heavy chain variable domain
- Antibody HC26AM light chain variable domain
- HCV E2 Antigen (residues 432-446)
|
|---|
 キーワード キーワード | IMMUNE SYSTEM / HCV / Broadly neutralizing Antibody |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
positive regulation of hexokinase activity / symbiont-mediated perturbation of host cellular process / translocation of peptides or proteins into host cell cytoplasm / Toll-like receptor 2 binding / viral capsid assembly / adhesion receptor-mediated virion attachment to host cell / hepacivirin / TBC/RABGAPs / host cell mitochondrial membrane / host cell lipid droplet ...positive regulation of hexokinase activity / symbiont-mediated perturbation of host cellular process / translocation of peptides or proteins into host cell cytoplasm / Toll-like receptor 2 binding / viral capsid assembly / adhesion receptor-mediated virion attachment to host cell / hepacivirin / TBC/RABGAPs / host cell mitochondrial membrane / host cell lipid droplet / symbiont-mediated transformation of host cell / symbiont-mediated suppression of host TRAF-mediated signal transduction / positive regulation of cytokinesis / symbiont-mediated perturbation of host cell cycle G1/S transition checkpoint / negative regulation of protein secretion / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / endoplasmic reticulum-Golgi intermediate compartment membrane / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of MAVS activity / SH3 domain binding / kinase binding / nucleoside-triphosphate phosphatase / channel activity / viral nucleocapsid / monoatomic ion transmembrane transport / clathrin-dependent endocytosis of virus by host cell / entry receptor-mediated virion attachment to host cell / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; システインプロテアーゼ / RNA helicase activity / host cell perinuclear region of cytoplasm / host cell endoplasmic reticulum membrane / RNA helicase / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / ribonucleoprotein complex / viral translational frameshifting / symbiont-mediated activation of host autophagy / RNA-directed RNA polymerase / serine-type endopeptidase activity / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / fusion of virus membrane with host endosome membrane / viral envelope / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity / negative regulation of transcription by RNA polymerase II / ATP hydrolysis activity / proteolysis / RNA binding / zinc ion binding / ATP binding類似検索 - 分子機能 Hepatitus C virus, Non-structural 5a protein, C-terminal / Hepatitis C virus NS5A, 1B domain superfamily / Hepatitis C virus non-structural protein NS2, C-terminal domain / Hepatitis C virus non-structural protein NS2, N-terminal domain / Hepatitis C virus non-structural protein NS2 / HCV NS5a protein C-terminal region / Hepatitis C virus, Non-structural protein NS4b / Hepatitis C virus, Core protein, N-terminal / Hepatitis C virus core protein, chain A superfamily / : ...Hepatitus C virus, Non-structural 5a protein, C-terminal / Hepatitis C virus NS5A, 1B domain superfamily / Hepatitis C virus non-structural protein NS2, C-terminal domain / Hepatitis C virus non-structural protein NS2, N-terminal domain / Hepatitis C virus non-structural protein NS2 / HCV NS5a protein C-terminal region / Hepatitis C virus, Non-structural protein NS4b / Hepatitis C virus, Core protein, N-terminal / Hepatitis C virus core protein, chain A superfamily / : / Hepatitis C virus non-structural protein NS4b / Hepatitis C virus capsid protein / Hepatitis C virus, Non-structural protein NS2 / Hepatitis C virus, Non-structural 5a protein / Hepatitis C virus, Non-structural 5a protein, domain 1a / Hepatitis C virus non-structural 5a, 1B domain / NS5A domain 1a superfamily / : / Hepatitis C virus non-structural 5a protein membrane anchor / Hepatitis C virus non-structural 5a zinc finger domain / Hepatitis C virus non-structural 5a domain 1b / NS3 RNA helicase, C-terminal helical domain / Hepacivirus nonstructural protein 2 (NS2) protease domain profile. / Hepatitis C virus, Non-structural protein NS4a / Hepatitis C virus non-structural protein NS4a / Hepatitis C virus, Core protein, C-terminal / Hepatitis C virus core protein / Hepatitis C virus, Non-structural protein E2/NS1 / Hepatitis C virus non-structural protein E2/NS1 / Hepatitis C virus, Envelope glycoprotein E1 / Hepatitis C virus envelope glycoprotein E1 / RNA dependent RNA polymerase, hepatitis C virus / Viral RNA dependent RNA polymerase / Hepatitis C virus, NS3 protease, Peptidase S29 / Hepatitis C virus NS3 protease / Hepacivirus/Pegivirus NS3 protease domain profile. / DEAD box, Flavivirus / Flavivirus DEAD domain / helicase superfamily c-terminal domain / Superfamilies 1 and 2 helicase C-terminal domain profile. / Superfamilies 1 and 2 helicase ATP-binding type-1 domain profile. / DEAD-like helicases superfamily / Helicase, C-terminal / Helicase superfamily 1/2, ATP-binding domain / Reverse transcriptase/Diguanylate cyclase domain / RNA-directed RNA polymerase, catalytic domain / RdRp of positive ssRNA viruses catalytic domain profile. / Peptidase S1, PA clan, chymotrypsin-like fold / Immunoglobulins / Peptidase S1, PA clan / DNA/RNA polymerase superfamily / Immunoglobulin-like / Sandwich / P-loop containing nucleoside triphosphate hydrolase / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)
 Hepacivirus C (ウイルス) Hepacivirus C (ウイルス) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å |
|---|
 データ登録者 データ登録者 | Rangarajan, S. / Shahid, S. / Mariuzza, R.A. |
|---|
 引用 引用 |  ジャーナル: Hepatology / 年: 2016 ジャーナル: Hepatology / 年: 2016
タイトル: Affinity maturation of a broadly neutralizing human monoclonal antibody that prevents acute hepatitis C virus infection in mice.
著者: Keck, Z.Y. / Wang, Y. / Lau, P. / Lund, G. / Rangarajan, S. / Fauvelle, C. / Liao, G.C. / Holtsberg, F.W. / Warfield, K.L. / Aman, M.J. / Pierce, B.G. / Fuerst, T.R. / Bailey, J.R. / Baumert, ...著者: Keck, Z.Y. / Wang, Y. / Lau, P. / Lund, G. / Rangarajan, S. / Fauvelle, C. / Liao, G.C. / Holtsberg, F.W. / Warfield, K.L. / Aman, M.J. / Pierce, B.G. / Fuerst, T.R. / Bailey, J.R. / Baumert, T.F. / Mariuzza, R.A. / Kneteman, N.M. / Foung, S.K. |
|---|
| 履歴 | | 登録 | 2015年3月26日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2016年7月20日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 2.0 | 2020年11月4日 | Group: Advisory / Atomic model ...Advisory / Atomic model / Data collection / Database references / Derived calculations / Other / Refinement description / Source and taxonomy / Structure summary
カテゴリ: atom_site / atom_site_anisotrop ...atom_site / atom_site_anisotrop / audit_author / cell / citation_author / diffrn / entity / entity_src_gen / pdbx_entity_src_syn / pdbx_nonpoly_scheme / pdbx_poly_seq_scheme / pdbx_refine_tls / pdbx_refine_tls_group / pdbx_struct_assembly_prop / pdbx_struct_oper_list / pdbx_struct_sheet_hbond / pdbx_unobs_or_zero_occ_atoms / pdbx_unobs_or_zero_occ_residues / pdbx_validate_close_contact / pdbx_validate_peptide_omega / pdbx_validate_rmsd_angle / pdbx_validate_symm_contact / pdbx_validate_torsion / refine / refine_hist / refine_ls_restr / refine_ls_shell / reflns / reflns_shell / software / struct / struct_conf / struct_conn / struct_ref_seq / struct_sheet_range / symmetry
Item: _cell.volume / _diffrn.pdbx_serial_crystal_experiment ..._cell.volume / _diffrn.pdbx_serial_crystal_experiment / _entity.pdbx_number_of_molecules / _entity_src_gen.pdbx_host_org_scientific_name / _entity_src_gen.pdbx_host_org_strain / _pdbx_entity_src_syn.organism_scientific / _pdbx_entity_src_syn.pdbx_beg_seq_num / _pdbx_entity_src_syn.pdbx_end_seq_num / _pdbx_poly_seq_scheme.auth_mon_id / _pdbx_poly_seq_scheme.auth_seq_num / _pdbx_poly_seq_scheme.pdb_mon_id / _pdbx_poly_seq_scheme.pdb_seq_num / _pdbx_struct_assembly_prop.value / _pdbx_struct_oper_list.symmetry_operation / _pdbx_struct_sheet_hbond.range_1_auth_comp_id / _pdbx_struct_sheet_hbond.range_1_auth_seq_id / _pdbx_struct_sheet_hbond.range_1_label_comp_id / _pdbx_struct_sheet_hbond.range_1_label_seq_id / _pdbx_struct_sheet_hbond.range_2_auth_comp_id / _pdbx_struct_sheet_hbond.range_2_auth_seq_id / _pdbx_struct_sheet_hbond.range_2_label_comp_id / _pdbx_struct_sheet_hbond.range_2_label_seq_id / _refine.B_iso_mean / _refine.ls_R_factor_R_free / _refine.ls_R_factor_R_work / _refine.ls_R_factor_obs / _refine.ls_d_res_low / _refine.ls_number_reflns_R_free / _refine.ls_number_reflns_R_work / _refine.ls_number_reflns_obs / _refine.ls_percent_reflns_R_free / _refine.ls_percent_reflns_obs / _refine.overall_SU_ML / _refine.pdbx_ls_sigma_F / _refine.pdbx_overall_phase_error / _refine.pdbx_starting_model / _refine.pdbx_stereochemistry_target_values / _refine_hist.d_res_low / _refine_hist.number_atoms_solvent / _refine_hist.number_atoms_total / _refine_hist.pdbx_number_atoms_protein / _refine_ls_restr.dev_ideal / _refine_ls_restr.number / _refine_ls_restr.type / _reflns.B_iso_Wilson_estimate / _struct.pdbx_CASP_flag / _struct_conf.beg_auth_seq_id / _struct_conf.end_auth_seq_id / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr2_auth_seq_id / _struct_ref_seq.db_align_beg / _struct_ref_seq.db_align_end / _struct_ref_seq.pdbx_auth_seq_align_beg / _struct_ref_seq.pdbx_auth_seq_align_end / _struct_sheet_range.beg_auth_comp_id / _struct_sheet_range.beg_auth_seq_id / _struct_sheet_range.beg_label_comp_id / _struct_sheet_range.beg_label_seq_id / _struct_sheet_range.end_auth_comp_id / _struct_sheet_range.end_auth_seq_id / _struct_sheet_range.end_label_comp_id / _struct_sheet_range.end_label_seq_id / _symmetry.space_group_name_Hall
解説: Atoms with unrealistic or zero occupancies / Provider: author / タイプ: Coordinate replacement |
|---|
| 改定 2.1 | 2023年3月1日 | Group: Database references / カテゴリ: citation / citation_author / database_2
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 2.2 | 2023年10月25日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 2.3 | 2024年10月23日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) Hepacivirus C (ウイルス)
Hepacivirus C (ウイルス) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2 Å
分子置換 / 解像度: 2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Hepatology / 年: 2016
ジャーナル: Hepatology / 年: 2016 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4z0x.cif.gz
4z0x.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4z0x.ent.gz
pdb4z0x.ent.gz PDB形式
PDB形式 4z0x.json.gz
4z0x.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4z0x_validation.pdf.gz
4z0x_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4z0x_full_validation.pdf.gz
4z0x_full_validation.pdf.gz 4z0x_validation.xml.gz
4z0x_validation.xml.gz 4z0x_validation.cif.gz
4z0x_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/z0/4z0x
https://data.pdbj.org/pub/pdb/validation_reports/z0/4z0x ftp://data.pdbj.org/pub/pdb/validation_reports/z0/4z0x
ftp://data.pdbj.org/pub/pdb/validation_reports/z0/4z0x リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 発現宿主:
Homo sapiens (ヒト) / 発現宿主: 
 Homo sapiens (ヒト) / 発現宿主:
Homo sapiens (ヒト) / 発現宿主: 
 Hepacivirus C (ウイルス) / 参照: UniProt: P27958*PLUS
Hepacivirus C (ウイルス) / 参照: UniProt: P27958*PLUS X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  NSLS
NSLS  / ビームライン: X29A / 波長: 1.075 Å
/ ビームライン: X29A / 波長: 1.075 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー



















 PDBj
PDBj





