[English] 日本語
 Yorodumi
Yorodumi- PDB-3tyz: Crystal Structure of the Yersinia pestis Dihydropteroate syntheta... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 3tyz | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of the Yersinia pestis Dihydropteroate synthetase with substrate transition state complex. | ||||||
 Components Components | 7,8-dihydropteroate synthase | ||||||
 Keywords Keywords | TRANSFERASE/TRANSFERASE SUBSTRATE / Dihydropteroate synthase / transition state complex / pABA / Tim barrel / TRANSFERASE-TRANSFERASE SUBSTRATE complex | ||||||
| Function / homology |  Function and homology information Function and homology informationdihydropteroate synthase / dihydropteroate synthase activity / folic acid biosynthetic process / tetrahydrofolate biosynthetic process / metal ion binding / cytosol Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 2.07 Å molecular replacement / Resolution: 2.07 Å | ||||||
 Authors Authors | Wu, Y. | ||||||
 Citation Citation |  Journal: Science / Year: 2012 Journal: Science / Year: 2012Title: Catalysis and sulfa drug resistance in dihydropteroate synthase. Authors: Yun, M.K. / Wu, Y. / Li, Z. / Zhao, Y. / Waddell, M.B. / Ferreira, A.M. / Lee, R.E. / Bashford, D. / White, S.W. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  3tyz.cif.gz 3tyz.cif.gz | 226.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb3tyz.ent.gz pdb3tyz.ent.gz | 180.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  3tyz.json.gz 3tyz.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ty/3tyz https://data.pdbj.org/pub/pdb/validation_reports/ty/3tyz ftp://data.pdbj.org/pub/pdb/validation_reports/ty/3tyz ftp://data.pdbj.org/pub/pdb/validation_reports/ty/3tyz | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  3tyaC  3tybC  3tycC  3tydC  3tyeC  3tyuC  3tzfC  3tznC  3v5oC C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 1 types, 2 molecules AB
| #1: Protein | Mass: 30317.729 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   References: UniProt: Q7CKJ1, UniProt: A0A2S9PLG4*PLUS, dihydropteroate synthase |
|---|
-Non-polymers , 5 types, 263 molecules 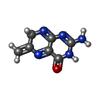
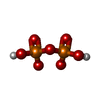







| #2: Chemical | | #3: Chemical | #4: Chemical | #5: Chemical | #6: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.18 Å3/Da / Density % sol: 43.65 % |
|---|---|
| Crystal grow | Temperature: 291 K / Method: vapor diffusion, sitting drop Details: PEG 20,000, MES(pH6.5), pH 6-7, VAPOR DIFFUSION, SITTING DROP, temperature 291K PH range: 6-7 |
-Data collection
| Diffraction | Mean temperature: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 22-BM / Wavelength: 0.97954 Å / Beamline: 22-BM / Wavelength: 0.97954 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: MARMOSAIC 225 mm CCD / Detector: CCD / Date: Apr 17, 2011 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Monochromator: Si-220 / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.97954 Å / Relative weight: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.07→50 Å / Num. obs: 31898 / % possible obs: 99 % / Observed criterion σ(I): -3 / Redundancy: 4.1 % / Rmerge(I) obs: 0.056 / Χ2: 0.906 / Net I/σ(I): 10.3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell |
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement |
|---|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT / Resolution: 2.07→50 Å / Cor.coef. Fo:Fc: 0.946 / Cor.coef. Fo:Fc free: 0.927 / Occupancy max: 1 / Occupancy min: 0.5 / SU B: 11.201 / SU ML: 0.137 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R Free: 0.186 / Stereochemistry target values: MAXIMUM LIKELIHOOD MOLECULAR REPLACEMENT / Resolution: 2.07→50 Å / Cor.coef. Fo:Fc: 0.946 / Cor.coef. Fo:Fc free: 0.927 / Occupancy max: 1 / Occupancy min: 0.5 / SU B: 11.201 / SU ML: 0.137 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R Free: 0.186 / Stereochemistry target values: MAXIMUM LIKELIHOODDetails: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : RESIDUAL ONLY
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.4 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 64.63 Å2 / Biso mean: 30.3874 Å2 / Biso min: 7.05 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.07→50 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.07→2.123 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj








