[English] 日本語
 Yorodumi
Yorodumi- PDB-3mbm: Crystal structure of 2C-methyl-D-erythritol 2,4-cyclodiphosphate ... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 3mbm | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of 2C-methyl-D-erythritol 2,4-cyclodiphosphate synthase from Burkholderia pseudomallei with cytosine and FoL fragment 717, imidazo[2,1-b][1,3]thiazol-6-ylmethanol | ||||||
 Components Components | 2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase | ||||||
 Keywords Keywords | LYASE / NIAID / Seattle Structural Genomics Center for Infectious Disease / SSGCID / IspF / cytosine / MEP pathway / fragment-based drug design / FBDD / Fragments of Life / Isoprene biosynthesis / Metal-binding | ||||||
| Function / homology |  Function and homology information Function and homology information2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase / 2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase activity / isopentenyl diphosphate biosynthetic process, methylerythritol 4-phosphate pathway / terpenoid biosynthetic process / metal ion binding Similarity search - Function | ||||||
| Biological species |  Burkholderia pseudomallei (bacteria) Burkholderia pseudomallei (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 1.8 Å molecular replacement / Resolution: 1.8 Å | ||||||
 Authors Authors | Seattle Structural Genomics Center for Infectious Disease (SSGCID) | ||||||
 Citation Citation |  Journal: J Struct Funct Genomics / Year: 2011 Journal: J Struct Funct Genomics / Year: 2011Title: Leveraging structure determination with fragment screening for infectious disease drug targets: MECP synthase from Burkholderia pseudomallei. Authors: Begley, D.W. / Hartley, R.C. / Davies, D.R. / Edwards, T.E. / Leonard, J.T. / Abendroth, J. / Burris, C.A. / Bhandari, J. / Myler, P.J. / Staker, B.L. / Stewart, L.J. #1:  Journal: Plos One / Year: 2013 Journal: Plos One / Year: 2013Title: Combining functional and structural genomics to sample the essential Burkholderia structome. Authors: Baugh, L. / Gallagher, L.A. / Patrapuvich, R. / Clifton, M.C. / Gardberg, A.S. / Edwards, T.E. / Armour, B. / Begley, D.W. / Dieterich, S.H. / Dranow, D.M. / Abendroth, J. / Fairman, J.W. / ...Authors: Baugh, L. / Gallagher, L.A. / Patrapuvich, R. / Clifton, M.C. / Gardberg, A.S. / Edwards, T.E. / Armour, B. / Begley, D.W. / Dieterich, S.H. / Dranow, D.M. / Abendroth, J. / Fairman, J.W. / Fox, D. / Staker, B.L. / Phan, I. / Gillespie, A. / Choi, R. / Nakazawa-Hewitt, S. / Nguyen, M.T. / Napuli, A. / Barrett, L. / Buchko, G.W. / Stacy, R. / Myler, P.J. / Stewart, L.J. / Manoil, C. / Van Voorhis, W.C. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  3mbm.cif.gz 3mbm.cif.gz | 107.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb3mbm.ent.gz pdb3mbm.ent.gz | 81.9 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  3mbm.json.gz 3mbm.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/mb/3mbm https://data.pdbj.org/pub/pdb/validation_reports/mb/3mbm ftp://data.pdbj.org/pub/pdb/validation_reports/mb/3mbm ftp://data.pdbj.org/pub/pdb/validation_reports/mb/3mbm | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  3f0dC  3f0eC  3f0gC  3ieqC  3iewC  3ikeSC  3ikfC  3jvhC  3k14C  3k2xC  3p0zC  3p10C  3qhdC S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | |
| Other databases |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
| ||||||||
| Components on special symmetry positions |
|
- Components
Components
-Protein , 1 types, 3 molecules ABC
| #1: Protein | Mass: 19487.109 Da / Num. of mol.: 3 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Burkholderia pseudomallei (bacteria) / Strain: 1710b / Gene: ispF, mecS, BPSL2098 / Production host: Burkholderia pseudomallei (bacteria) / Strain: 1710b / Gene: ispF, mecS, BPSL2098 / Production host:  References: UniProt: Q63T71, UniProt: Q3JRA0*PLUS, 2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase |
|---|
-Non-polymers , 5 types, 251 molecules 
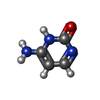
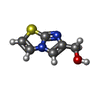






| #2: Chemical | | #3: Chemical | #4: Chemical | #5: Chemical | ChemComp-TRS / | #6: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.03 Å3/Da / Density % sol: 39.33 % |
|---|---|
| Crystal grow | Temperature: 289 K / Method: vapor diffusion, sitting drop / pH: 8 Details: 20% PEG 4000, 100 mM Tris, 200 mM NaCl, 5 mM ZnCl2 with 34.4 mg/mL protein for 3 days. Crystal soaked in 25 mM cytosine and fragment 717 in same buffer for 3 weeks. VAPOR DIFFUSION, SITTING ...Details: 20% PEG 4000, 100 mM Tris, 200 mM NaCl, 5 mM ZnCl2 with 34.4 mg/mL protein for 3 days. Crystal soaked in 25 mM cytosine and fragment 717 in same buffer for 3 weeks. VAPOR DIFFUSION, SITTING DROP, temperature 289K, pH 8.0 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU FR-E+ SUPERBRIGHT / Wavelength: 1.5418 Å ROTATING ANODE / Type: RIGAKU FR-E+ SUPERBRIGHT / Wavelength: 1.5418 Å |
| Detector | Type: RIGAKU SATURN 944+ / Detector: CCD / Date: Feb 22, 2010 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 |
| Reflection | Resolution: 1.8→50 Å / Num. obs: 41626 / % possible obs: 88.4 % / Redundancy: 1.7 % / Rmerge(I) obs: 0.081 / Χ2: 1.037 / Net I/σ(I): 20.1 |
| Reflection shell | Resolution: 1.8→1.83 Å / Redundancy: 1.2 % / Rmerge(I) obs: 0.256 / Mean I/σ(I) obs: 2.52 / Num. unique all: 3545 / Χ2: 1.166 / % possible all: 81.6 |
-Phasing
| Phasing | Method:  molecular replacement molecular replacement | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR | Rfactor: 34.26 / Model details: Phaser MODE: MR_AUTO
|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB entry 3ike Resolution: 1.8→25.5 Å / Cor.coef. Fo:Fc: 0.958 / Cor.coef. Fo:Fc free: 0.945 / WRfactor Rfree: 0.258 / WRfactor Rwork: 0.228 / Occupancy max: 1 / Occupancy min: 0.5 / FOM work R set: 0.84 / SU B: 5.768 / SU ML: 0.088 / SU R Cruickshank DPI: 0.136 / SU Rfree: 0.124 / TLS residual ADP flag: LIKELY RESIDUAL / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.136 / ESU R Free: 0.124 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES: RESIDUAL ONLY
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.4 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 50.35 Å2 / Biso mean: 6.423 Å2 / Biso min: 2 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.8→25.5 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.8→1.847 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj



