+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2bwu | ||||||
|---|---|---|---|---|---|---|---|
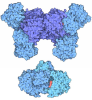
| Title | Asp271Ala Escherichia coli Aminopeptidase P | ||||||
 Components Components | AMINOPEPTIDASE P | ||||||
 Keywords Keywords | HYDROLASE / AMINOPEPTIDASE P / METALLOENZYME / 'PITA-BREAD' ENZYME / PROLINE-SPECIFIC ENZYME / MANGANESE ENZYME | ||||||
| Function / homology |  Function and homology information Function and homology informationXaa-Pro aminopeptidase / metalloexopeptidase activity / metalloaminopeptidase activity / aminopeptidase activity / manganese ion binding / protein homotetramerization / protein-containing complex / proteolysis / identical protein binding / cytosol Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.2 Å MOLECULAR REPLACEMENT / Resolution: 2.2 Å | ||||||
 Authors Authors | Graham, S.C. / Guss, J.M. | ||||||
 Citation Citation |  Journal: Biochemistry / Year: 2006 Journal: Biochemistry / Year: 2006Title: Kinetic and Crystallographic Analysis of Mutant Escherichia Coli Aminopeptidase P: Insights Into Substrate Recognition and the Mechanism of Catalysis. Authors: Graham, S.C. / Lilley, P.E. / Lee, M. / Schaeffer, P.M. / Kralicek, A.V. / Dixon, N.E. / Guss, J.M. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2bwu.cif.gz 2bwu.cif.gz | 104 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2bwu.ent.gz pdb2bwu.ent.gz | 79.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2bwu.json.gz 2bwu.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/bw/2bwu https://data.pdbj.org/pub/pdb/validation_reports/bw/2bwu ftp://data.pdbj.org/pub/pdb/validation_reports/bw/2bwu ftp://data.pdbj.org/pub/pdb/validation_reports/bw/2bwu | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  2bwsC  2bwtC  2bwvC  2bwwC  2bwxC  2bwyC  2bhcS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||
| Unit cell |
| |||||||||
| Components on special symmetry positions |
|
- Components
Components
| #1: Protein | Mass: 49700.055 Da / Num. of mol.: 1 / Mutation: YES Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
|---|---|
| #2: Chemical | ChemComp-NA / |
| #3: Chemical | ChemComp-MG / |
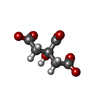
| #4: Chemical | ChemComp-FLC / |
| #5: Water | ChemComp-HOH / |
| Compound details | ENGINEERED |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 5.6 Å3/Da / Density % sol: 77.9 % / Description: STARTING MODEL WAS STRIPPED OF HETATMS. |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop / pH: 7.5 Details: SITTING DROP VAPOUR DIFFUSION AT 4C. 2 UL 10 MG/ML APPRO PLUS 2 UL RESERVOIR SOLUTION: 30% MPD, 0.1 M CITRATE PH 7.5, 0.2 M MGACETATE. SOAKED IN RESERVOIR SOLUTION SUPPLEMENTED WITH AND 1 MM ...Details: SITTING DROP VAPOUR DIFFUSION AT 4C. 2 UL 10 MG/ML APPRO PLUS 2 UL RESERVOIR SOLUTION: 30% MPD, 0.1 M CITRATE PH 7.5, 0.2 M MGACETATE. SOAKED IN RESERVOIR SOLUTION SUPPLEMENTED WITH AND 1 MM MNCL2 FOR 1 HR AT 4C PRIOR TO CRYOCOOLING. |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRL SSRL  / Beamline: BL9-2 / Wavelength: 0.98086 / Beamline: BL9-2 / Wavelength: 0.98086 |
| Detector | Type: MARRESEARCH / Detector: CCD / Date: May 3, 2005 |
| Radiation | Monochromator: DOUBLE CRYSTAL MONOCHROMATOR / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.98086 Å / Relative weight: 1 |
| Reflection | Resolution: 2.2→22.58 Å / Num. obs: 56922 / % possible obs: 99.4 % / Observed criterion σ(I): 6 / Redundancy: 4.1 % / Biso Wilson estimate: 50.46 Å2 / Rmerge(I) obs: 0.06 / Net I/σ(I): 13.6 |
| Reflection shell | Resolution: 2.2→2.32 Å / Redundancy: 4.1 % / Rmerge(I) obs: 0.55 / Mean I/σ(I) obs: 1.8 / % possible all: 100 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 2BHC Resolution: 2.2→22.65 Å / Cor.coef. Fo:Fc: 0.975 / Cor.coef. Fo:Fc free: 0.966 / SU B: 8.096 / SU ML: 0.098 / TLS residual ADP flag: LIKELY RESIDUAL / Cross valid method: THROUGHOUT / ESU R: 0.117 / ESU R Free: 0.114 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS. INSUFFICIENT DENSITY WAS AVAILABLE FOR COMPLETE MODELLING OF RESIDUES 439-440. THE METAL SITE IS HIGHLY DISORDERED AND THE POSSIBILITY OF ...Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS. INSUFFICIENT DENSITY WAS AVAILABLE FOR COMPLETE MODELLING OF RESIDUES 439-440. THE METAL SITE IS HIGHLY DISORDERED AND THE POSSIBILITY OF METAL HETEROGENEITY CANNOT BE DISCOUNTED.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 57.52 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.2→22.65 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller



































 PDBj
PDBj