+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1tmm | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of ternary complex of E.coli HPPK(W89A) with MGAMPCPP and 6-Hydroxymethylpterin | ||||||
 要素 要素 | 2-amino-4-hydroxy-6-hydroxymethyldihydropteridine pyrophosphokinase | ||||||
 キーワード キーワード | TRANSFERASE / PYROPHOSPHOKINASE / PYROPHOSPHORYL TRANSFER / CATALYTIC MECHANISM / FOLATE / HPPK / PTERIN / 6-HYDROXYMETHYL-7 / 8-DIHYDROPTERIN / 6-HYDROXYMETHYLPTERIN / TERNARY COMPLEX / SUBSTRATE SPECIFICITY / PRODUCT RELEASE / ANTIMICROBIAL AGENT / DRUG DESIGN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報2-amino-4-hydroxy-6-hydroxymethyldihydropteridine diphosphokinase / 2-amino-4-hydroxy-6-hydroxymethyldihydropteridine diphosphokinase activity / folic acid biosynthetic process / tetrahydrofolate biosynthetic process / kinase activity / magnesium ion binding / ATP binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.25 Å 分子置換 / 解像度: 1.25 Å | ||||||
 データ登録者 データ登録者 | Blaszczyk, J. / Li, Y. / Wu, Y. / Shi, G. / Ji, X. / Yan, H. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2005 ジャーナル: Biochemistry / 年: 2005タイトル: Is the Critical Role of Loop 3 of Escherichia coli 6-Hydroxymethyl-7,8-dihydropterin Pyrophosphokinase in Catalysis Due to Loop-3 Residues Arginine-84 and Tryptophan-89? Site-Directed ...タイトル: Is the Critical Role of Loop 3 of Escherichia coli 6-Hydroxymethyl-7,8-dihydropterin Pyrophosphokinase in Catalysis Due to Loop-3 Residues Arginine-84 and Tryptophan-89? Site-Directed Mutagenesis, Biochemical, and Crystallographic Studies. 著者: Li, Y. / Blaszczyk, J. / Wu, Y. / Shi, G. / Ji, X. / Yan, H. #1:  ジャーナル: Structure / 年: 1999 ジャーナル: Structure / 年: 1999タイトル: Crystal Structure of 6-Hydroxymethyl-7,8-Dihydropterin Pyrophosphokinase, a Potential Target for the Development of Novel Antimicrobial Agents 著者: Xiao, B. / Shi, G. / Chen, X. / Yan, H. / Ji, X. #2:  ジャーナル: Structure / 年: 2000 ジャーナル: Structure / 年: 2000タイトル: Catalytic Center Assembly of Hppk as Revealed by the Crystal Structure of a Ternary Complex at 1.25 A Resolution 著者: Blaszczyk, J. / Shi, G. / Yan, H. / Ji, X. #3:  ジャーナル: J.Med.Chem. / 年: 2001 ジャーナル: J.Med.Chem. / 年: 2001タイトル: Bisubstrate Analogue Inhibitors of 6-Hydroxymethyl-7,8-Dihydropterin Pyrophosphokinase: Synthesis and Biochemical and Crystallographic Studies 著者: Shi, G. / Blaszczyk, J. / Ji, X. / Yan, H. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1tmm.cif.gz 1tmm.cif.gz | 182.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1tmm.ent.gz pdb1tmm.ent.gz | 140.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1tmm.json.gz 1tmm.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1tmm_validation.pdf.gz 1tmm_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1tmm_full_validation.pdf.gz 1tmm_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  1tmm_validation.xml.gz 1tmm_validation.xml.gz | 25 KB | 表示 | |
| CIF形式データ |  1tmm_validation.cif.gz 1tmm_validation.cif.gz | 36.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/tm/1tmm https://data.pdbj.org/pub/pdb/validation_reports/tm/1tmm ftp://data.pdbj.org/pub/pdb/validation_reports/tm/1tmm ftp://data.pdbj.org/pub/pdb/validation_reports/tm/1tmm | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 17851.402 Da / 分子数: 2 / 変異: W89A / 由来タイプ: 組換発現 / 由来: (組換発現)   参照: UniProt: P26281, 2-amino-4-hydroxy-6-hydroxymethyldihydropteridine diphosphokinase |
|---|
-非ポリマー , 7種, 670分子 


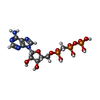
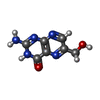








| #2: 化合物 | ChemComp-MG / #3: 化合物 | #4: 化合物 | ChemComp-ACT / #5: 化合物 | #6: 化合物 | #7: 化合物 | #8: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.88 Å3/Da / 溶媒含有率: 24.5 % |
|---|---|
| 結晶化 | 温度: 292 K / pH: 4.6 詳細: PEG4000, MAGNESIUM CHLORIDE, ACETATE, GLYCEROL, pH 4.6, VAPOR DIFFUSION, HANGING DROP, temperature 292.0K, pH 4.60 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSLS NSLS  / ビームライン: X9B / 波長: 0.97793 / ビームライン: X9B / 波長: 0.97793 |
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 2000年10月2日 / 詳細: MIRROR |
| 放射 | モノクロメーター: SILICON 111 / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97793 Å / 相対比: 1 |
| 反射 | 解像度: 1.25→30 Å / Num. obs: 85986 / % possible obs: 99.8 % / Observed criterion σ(I): 0 / 冗長度: 4.037 % / Biso Wilson estimate: 14.4 Å2 / Rmerge(I) obs: 0.078 / Net I/σ(I): 16.8 |
| 反射 シェル | 解像度: 1.25→1.29 Å / 冗長度: 3.47 % / Rmerge(I) obs: 0.602 / Mean I/σ(I) obs: 2 / % possible all: 99.3 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB 1Q0N 解像度: 1.25→30 Å / Num. parameters: 26939 / Num. restraintsaints: 34724 / 交差検証法: FREE R / σ(F): 4 / 立体化学のターゲット値: ENGH AND HUBER 詳細: FULL MATRIX LEAST-SQUARES PROCEDURE, WITH BLOCK OF PARAMETERS SET FOR EACH CYCLE OF INISOTROPIC REFINEMENT
| ||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 16.7 Å2 | ||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.137 Å / Luzzati d res low obs: 5 Å / Num. disordered residues: 14 / Occupancy sum hydrogen: 2430 / Occupancy sum non hydrogen: 3294.5 | ||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.25→30 Å
| ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー






























 PDBj
PDBj









