[English] 日本語
 Yorodumi
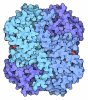
Yorodumi- PDB-1p1r: Horse liver alcohol dehydrogenase complexed with NADH and R-N-1-m... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1p1r | ||||||
|---|---|---|---|---|---|---|---|
| Title | Horse liver alcohol dehydrogenase complexed with NADH and R-N-1-methylhexylformamide | ||||||
 Components Components | Alcohol dehydrogenase E chain | ||||||
 Keywords Keywords | OXIDOREDUCTASE / puckered reduced nicotinamide ring / Michaelis complex analogue / formamide | ||||||
| Function / homology |  Function and homology information Function and homology informationall-trans-retinol dehydrogenase (NAD+) activity / alcohol dehydrogenase / retinoic acid metabolic process / retinol metabolic process / zinc ion binding / cytosol Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.57 Å MOLECULAR REPLACEMENT / Resolution: 1.57 Å | ||||||
 Authors Authors | Venkataramaiah, T.H. / Plapp, B.V. | ||||||
 Citation Citation |  Journal: J.Biol.Chem. / Year: 2003 Journal: J.Biol.Chem. / Year: 2003Title: Formamides mimic aldehydes and inhibit liver alcohol dehydrogenases and ethanol metabolism Authors: Venkataramaiah, T.H. / Plapp, B.V. #1:  Journal: Biochemistry / Year: 1997 Journal: Biochemistry / Year: 1997Title: Flexibility of liver alcohol dehydrogenase in stereoselective binding of 3-butylthiolane 1-oxides Authors: Cho, H. / Ramaswamy, S. / Plapp, B.V. #2:  Journal: J.Biol.Chem. / Year: 1982 Journal: J.Biol.Chem. / Year: 1982Title: BINDING OF SUBSTRATE IN A TERNARY COMPLEX OF HORSE LIVER ALCOHOL DEHYDROGENASE Authors: Eklund, H. / Plapp, B.V. / Samama, J.P. / Branden, C.I. #3:  Journal: Biochemistry / Year: 1999 Journal: Biochemistry / Year: 1999Title: SUBSTITUTIONS IN A FLEXIBLE LOOP OF HORSE LIVER ALCOHOL DEHYDROGENASE HINDER THE CONFORMATIONAL CHANGE AND UNMASK HYDROGEN TRANSFER Authors: Ramaswamy, S. / Park, D.H. / Plapp, B.V. #4:  Journal: Acta Crystallogr.,Sect.D / Year: 1994 Journal: Acta Crystallogr.,Sect.D / Year: 1994Title: Refined crystal structure of liver alcohol dehydrogenase-NADH complex at 1.8 angstrom resolution Authors: Al-Karadaghi, S. / Cedergren-Zeppezauer, E.S. / Hovmoller, S. / Petratos, K. / Terry, H. / Wilson, K.S. #5:  Journal: J.Mol.Biol. / Year: 1981 Journal: J.Mol.Biol. / Year: 1981Title: STRUCTURE OF A TRICLINIC TERNARY COMPLEX OF HORSE LIVER ALCOHOL DEHYDROGENASE AT 2.9 A RESOLUTION Authors: Eklund, H. / Samama, J.P. / Wallen, L. / Branden, C.I. / Akeson, A. / Jones, T.A. #6:  Journal: J.Mol.Biol. / Year: 1976 Journal: J.Mol.Biol. / Year: 1976Title: Three-dimensional structure of horse liver alcohol dehydrogenase at 2.4 A resolution Authors: Eklund, H. / Nordstrom, B. / Zeppezauer, E. / Soderlund, G. / Ohlsson, I. / Boiwe, T. / Soderberg, B.O. / Tapia, O. / Branden, C.I. / Akeson, A. #7:  Journal: Biochemistry / Year: 1994 Journal: Biochemistry / Year: 1994Title: Structures of horse liver alcohol dehydrogenase complexed with NAD+ and substituted benzyl alcohols Authors: Ramaswamy, S. / Eklund, H. / Plapp, B.V. #8:  Journal: J.Biol.Chem. / Year: 2001 Journal: J.Biol.Chem. / Year: 2001Title: On the enzymatic activation of NADH Authors: Meijers, R. / Morris, R.J. / Adolph, H.W. / Merli, A. / Lamzin, V.S. / Cedergren-Zeppezauer, E.S. #9:  Journal: Biochemistry / Year: 2003 Journal: Biochemistry / Year: 2003Title: Amino acid residues in the Nicotinamide Binding site Contribute to Catalysis by horse liver alcohol dehydrogenase Authors: Rubach, J.K. / Plapp, B.V. #10:  Journal: Biochemistry / Year: 1997 Journal: Biochemistry / Year: 1997Title: Binding of formamides to liver alcohol dehydrogenase Authors: Ramaswamy, S. / Scholze, M. / Plapp, B.V. | ||||||
| History |
| ||||||
| Remark 600 | Heterogen THE STRUCTURE DETERMINED IN THIS ENTRY CONTAINS THE HETEROATOM MOLECULE NAI, WHICH IS 1,4- ...Heterogen THE STRUCTURE DETERMINED IN THIS ENTRY CONTAINS THE HETEROATOM MOLECULE NAI, WHICH IS 1,4-DIHYDRONICOTINAMIDE ADENINE DINUCLEOTIDE. BUT THE RESTRAINTS ON THE PLANARITY OF THE NICOTINAMIDE RING WERE REMOVED DURING REFINEMENT WITH THE RESULT THAT THE RING IS PUCKERED. THE COMPLEX ALSO HAS THE R ISOMER OF THE N-1-METHYLHEXYLFORMAMIDE BOUND TO THE CATALYTIC ZINC, RESIDUE 376 IN CHAINS A, B, C, AND D. |
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1p1r.cif.gz 1p1r.cif.gz | 579 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1p1r.ent.gz pdb1p1r.ent.gz | 475.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1p1r.json.gz 1p1r.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/p1/1p1r https://data.pdbj.org/pub/pdb/validation_reports/p1/1p1r ftp://data.pdbj.org/pub/pdb/validation_reports/p1/1p1r ftp://data.pdbj.org/pub/pdb/validation_reports/p1/1p1r | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  1hldS S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 1 types, 4 molecules ABCD
| #1: Protein | Mass: 39853.273 Da / Num. of mol.: 4 / Source method: isolated from a natural source / Source: (natural)  |
|---|
-Non-polymers , 5 types, 1258 molecules 
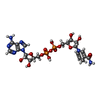
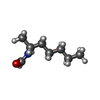
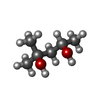





| #2: Chemical | ChemComp-ZN / #3: Chemical | ChemComp-NAI / #4: Chemical | ChemComp-NMH / ( #5: Chemical | ChemComp-MPD / ( | #6: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.14 Å3/Da / Density % sol: 41.95 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | Temperature: 277 K / pH: 7 Details: MPD, 50 mM ammonium tris-[(hydroxymethyl)methyl]-2-aminosulfonate buffer, 0.25 mM EDTA, pH 7.0, dialysis, temperature 277K | ||||||||||||||||||||||||||||||
| Crystal grow | *PLUS Temperature: 4 ℃ / pH: 6.7 / Method: unknown | ||||||||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 17-ID / Wavelength: 1 Å / Beamline: 17-ID / Wavelength: 1 Å |
| Detector | Type: MARRESEARCH / Detector: CCD / Date: Dec 9, 2001 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1 Å / Relative weight: 1 |
| Reflection | Resolution: 1.57→20 Å / Num. all: 191371 / Num. obs: 191371 / % possible obs: 94.29 % / Observed criterion σ(F): 1 / Redundancy: 3.3 % / Biso Wilson estimate: 24.3 Å2 / Rmerge(I) obs: 0.047 / Rsym value: 0.047 / Net I/σ(I): 32.9 |
| Reflection shell | Resolution: 1.57→1.63 Å / Redundancy: 2.8 % / Mean I/σ(I) obs: 5.2 / Num. unique all: 16092 / Rsym value: 0.2 / % possible all: 79 |
| Reflection | *PLUS Num. obs: 192617 / % possible obs: 94.3 % / Num. measured all: 636860 |
| Reflection shell | *PLUS % possible obs: 79 % / Rmerge(I) obs: 0.2 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 1HLD Resolution: 1.57→20 Å / Cor.coef. Fo:Fc: 0.969 / Cor.coef. Fo:Fc free: 0.951 / SU B: 1.305 / SU ML: 0.047 / Isotropic thermal model: Anisotropic / Cross valid method: THROUGHOUT / σ(I): 1 / ESU R: 0.095 / ESU R Free: 0.082 / Stereochemistry target values: MAXIMUM LIKELIHOOD / Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.4 Å / Solvent model: BABINET MODEL WITH MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 19.166 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.57→20 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.57→1.614 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement | *PLUS Lowest resolution: 20 Å / Rfactor Rfree: 0.2 / Rfactor Rwork: 0.153 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints | *PLUS
|
 Movie
Movie Controller
Controller



























 PDBj
PDBj