+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3674 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | RNF169 chromatin binding region bound to a ubiquitylated nucleosome | |||||||||
 マップデータ マップデータ | MIU-LRM region of RNF169 bound to a ubiquitylated nucleosome core particle | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
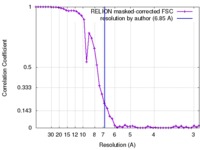
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 6.85 Å | |||||||||
 データ登録者 データ登録者 | Wilson MD / Kitevski-LeBlanc J / Durocher D / Rubinstein JL / Kay LE | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2017 ジャーナル: Elife / 年: 2017タイトル: The RNF168 paralog RNF169 defines a new class of ubiquitylated histone reader involved in the response to DNA damage. 著者: Julianne Kitevski-LeBlanc / Amélie Fradet-Turcotte / Predrag Kukic / Marcus D Wilson / Guillem Portella / Tairan Yuwen / Stephanie Panier / Shili Duan / Marella D Canny / Hugo van Ingen / ...著者: Julianne Kitevski-LeBlanc / Amélie Fradet-Turcotte / Predrag Kukic / Marcus D Wilson / Guillem Portella / Tairan Yuwen / Stephanie Panier / Shili Duan / Marella D Canny / Hugo van Ingen / Cheryl H Arrowsmith / John L Rubinstein / Michele Vendruscolo / Daniel Durocher / Lewis E Kay /    要旨: Site-specific histone ubiquitylation plays a central role in orchestrating the response to DNA double-strand breaks (DSBs). DSBs elicit a cascade of events controlled by the ubiquitin ligase RNF168, ...Site-specific histone ubiquitylation plays a central role in orchestrating the response to DNA double-strand breaks (DSBs). DSBs elicit a cascade of events controlled by the ubiquitin ligase RNF168, which promotes the accumulation of repair factors such as 53BP1 and BRCA1 on the chromatin flanking the break site. RNF168 also promotes its own accumulation, and that of its paralog RNF169, but how they recognize ubiquitylated chromatin is unknown. Using methyl-TROSY solution NMR spectroscopy and molecular dynamics simulations, we present an atomic resolution model of human RNF169 binding to a ubiquitylated nucleosome, and validate it by electron cryomicroscopy. We establish that RNF169 binds to ubiquitylated H2A-Lys13/Lys15 in a manner that involves its canonical ubiquitin-binding helix and a pair of arginine-rich motifs that interact with the nucleosome acidic patch. This three-pronged interaction mechanism is distinct from that by which 53BP1 binds to ubiquitylated H2A-Lys15 highlighting the diversity in site-specific recognition of ubiquitylated nucleosomes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3674.map.gz emd_3674.map.gz | 2.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3674-v30.xml emd-3674-v30.xml emd-3674.xml emd-3674.xml | 15.4 KB 15.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_3674_fsc.xml emd_3674_fsc.xml | 4.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_3674.png emd_3674.png | 45 KB | ||
| その他 |  emd_3674_additional.map.gz emd_3674_additional.map.gz | 3.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3674 http://ftp.pdbj.org/pub/emdb/structures/EMD-3674 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3674 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3674 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3674_validation.pdf.gz emd_3674_validation.pdf.gz | 242.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3674_full_validation.pdf.gz emd_3674_full_validation.pdf.gz | 241.8 KB | 表示 | |
| XML形式データ |  emd_3674_validation.xml.gz emd_3674_validation.xml.gz | 8.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3674 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3674 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3674 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3674 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3674.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3674.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | MIU-LRM region of RNF169 bound to a ubiquitylated nucleosome core particle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.45 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: H2A K13 disulphide conjugated nuclesome core particlce
| ファイル | emd_3674_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | H2A K13 disulphide conjugated nuclesome core particlce | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
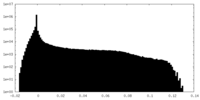
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RNF169/NCP-ub complex
| 全体 | 名称: RNF169/NCP-ub complex |
|---|---|
| 要素 |
|
-超分子 #1: RNF169/NCP-ub complex
| 超分子 | 名称: RNF169/NCP-ub complex / タイプ: complex / ID: 1 / 親要素: 0 詳細: MIU-LRM region of RNF169 bound to H2AK13 disulphide ubiquitylated Nucleosome core particle |
|---|---|
| 分子量 | 理論値: 230 kDa/nm |
-超分子 #2: RNF169 MIU-LRM region
| 超分子 | 名称: RNF169 MIU-LRM region / タイプ: complex / ID: 2 / 親要素: 1 詳細: SUMO-RNF169 residues 662-708 was expressed recombinantly including a DAAA helix stabilizing extension. SUMO tag was removed by Ulp1 cleavage prior to formation of RNF169/NCP-ub complex |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 10 kDa/nm |
-超分子 #3: H2AK13 ubiquitylated Nucleosome core particle
| 超分子 | 名称: H2AK13 ubiquitylated Nucleosome core particle / タイプ: complex / ID: 3 / 親要素: 1 詳細: recombinant Drosophila histones wrapped with synthetic strong positioning Widom-601 DNA. Ubiquitin G76C covalently tethered to engineered K13C residue in H2A, prior to NCP reconstitution |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 220 kDa/nm |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.57 mg/mL |
|---|---|
| 緩衝液 | pH: 6.8 / 詳細: 10 mM tris pH 6.8, 30 mM KCl 13 and 1mM EDTA |
| グリッド | モデル: homemade / 材質: GOLD / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK III |
| 詳細 | NCP-ub and RNF169 fragment were mixed at 1:5 ratio |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 詳細 | 5 separate sessions of manual data collection were combined. |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 5 / 実像数: 867 / 平均露光時間: 15.0 sec. / 平均電子線量: 36.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 34483 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 倍率(公称値): 25000 |
| 試料ステージ | 試料ホルダーモデル: GATAN 626 SINGLE TILT LIQUID NITROGEN CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)