+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1c6z | ||||||
|---|---|---|---|---|---|---|---|
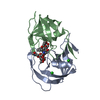
| タイトル | ALTERNATE BINDING SITE FOR THE P1-P3 GROUP OF A CLASS OF POTENT HIV-1 PROTEASE INHIBITORS AS A RESULT OF CONCERTED STRUCTURAL CHANGE IN 80'S LOOP. | ||||||
 要素 要素 | PROTEIN (PROTEASE) | ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / hydrolase-hydrolase inhibitor complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |    Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) | ||||||
| 手法 |  X線回折 / 解像度: 2.5 Å X線回折 / 解像度: 2.5 Å | ||||||
 データ登録者 データ登録者 | Munshi, S. | ||||||
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.D / 年: 2000 ジャーナル: Acta Crystallogr.,Sect.D / 年: 2000タイトル: An alternate binding site for the P1-P3 group of a class of potent HIV-1 protease inhibitors as a result of concerted structural change in the 80s loop of the protease. 著者: Munshi, S. / Chen, Z. / Yan, Y. / Li, Y. / Olsen, D.B. / Schock, H.B. / Galvin, B.B. / Dorsey, B. / Kuo, L.C. #1:  ジャーナル: J.Med.Chem. / 年: 1991 ジャーナル: J.Med.Chem. / 年: 1991タイトル: Novel Binding Mode of Highly Potent HIV-Proteinase Inhibitors Incorporating the (R)-Hydroxyethylamine Isostere 著者: Krohn, A. / Redshaw, S. / Ritchie, J.C. / Graves, B.J. / Hatada, M.H. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1c6z.cif.gz 1c6z.cif.gz | 53.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1c6z.ent.gz pdb1c6z.ent.gz | 39.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1c6z.json.gz 1c6z.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/c6/1c6z https://data.pdbj.org/pub/pdb/validation_reports/c6/1c6z ftp://data.pdbj.org/pub/pdb/validation_reports/c6/1c6z ftp://data.pdbj.org/pub/pdb/validation_reports/c6/1c6z | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 10801.674 Da / 分子数: 2 / 由来タイプ: 組換発現 / 詳細: NY5 ISOLATE 由来: (組換発現)    Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)属: Lentivirus  レンチウイルス属 / 遺伝子: NY5 ISOLATE / 発現宿主: レンチウイルス属 / 遺伝子: NY5 ISOLATE / 発現宿主:   Escherichia coli (大腸菌) Escherichia coli (大腸菌)参照: UniProt: O09893,  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; その他のペプチターゼ 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; その他のペプチターゼ#2: 化合物 | ChemComp-ROC / ( |  サキナビル / Fortovase / SAQUINAVIR / RO 31-8959 / サキナビル / サキナビル / Fortovase / SAQUINAVIR / RO 31-8959 / サキナビル /  サキナビル サキナビル#3: 水 | ChemComp-HOH / |  水 水構成要素の詳細 | 9X MUTANT PROTEASE HAS NINE POINT MUTATIONS COMPARED TO WILD TYPE: ...9X MUTANT PROTEASE HAS NINE POINT MUTATIONS COMPARED TO WILD TYPE: L10V,K20M,L24I,S37D,M46I,I54V,L63P,A71V,V82T THERE IS ONE PROTEASE DIMER IN AN ASYMMETRIC | 非ポリマーの詳細 | THE INHIBITOR ROC IS A HYDROXYETH | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.96 Å3/Da / 溶媒含有率: 58.5 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | 詳細: CRYSTALS OBTAINED BY CO-CRYSTALLIZATION AT PH 5.2, USING 0.6M NaCl AS PRECIPITATING AGENT IN 0.1M SODIUM ACETATE BUFFER. PROTEIN WAS AT 5.5 MG/ML CONCENTRATION. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS pH: 5 / 手法: 蒸気拡散法, ハンギングドロップ法詳細: inhibitor-protein mixture and the reservoir solution were mixed in a 1:1(v/v) ratio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
|---|---|
| 放射波長 | 相対比: 1 |
| 反射 | Num. all: 41654 / Num. obs: 7717 / % possible obs: 82 % / Rmerge(I) obs: 0.062 |
| 反射 シェル | 解像度: 2.5→2.59 Å / % possible all: 73 |
| 反射 | *PLUS 最高解像度: 2.5 Å / 最低解像度: 20 Å / Num. measured all: 41654 |
| 反射 シェル | *PLUS % possible obs: 73 % / Num. unique obs: 677 / Num. measured obs: 2345 / Rmerge(I) obs: 0.224 / Mean I/σ(I) obs: 4 |
- 解析
解析
| ソフトウェア | 名称:  X-PLOR / 分類: 精密化 X-PLOR / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2.5→8 Å / Rfactor Rfree : 0.29 / Rfactor Rwork : 0.29 / Rfactor Rwork : 0.18 / Rfactor obs: 0.18 / σ(F): 2 : 0.18 / Rfactor obs: 0.18 / σ(F): 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.5→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj