| 登録情報 | データベース: PDB / ID: 6y4s
|
|---|
| タイトル | Human kallikrein-related peptidase 7 (KLK7) in the unliganded state |
|---|
 要素 要素 | Kallikrein-7 |
|---|
 キーワード キーワード | HYDROLASE / kallikrein 7 / hK7 / serine protease |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
stratum corneum chymotryptic enzyme / positive regulation of antibacterial peptide production / epidermal lamellar body / cornified envelope / Differentiation of Keratinocytes in Interfollicular Epidermis in Mammalian Skin / extracellular matrix disassembly / epidermis development / Degradation of the extracellular matrix / serine-type peptidase activity / secretory granule ...stratum corneum chymotryptic enzyme / positive regulation of antibacterial peptide production / epidermal lamellar body / cornified envelope / Differentiation of Keratinocytes in Interfollicular Epidermis in Mammalian Skin / extracellular matrix disassembly / epidermis development / Degradation of the extracellular matrix / serine-type peptidase activity / secretory granule / protein maturation / metalloendopeptidase activity / peptidase activity / serine-type endopeptidase activity / proteolysis / extracellular space / extracellular region類似検索 - 分子機能 Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, serine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin family, serine active site. / Serine proteases, trypsin domain profile. / Trypsin-like serine protease / Serine proteases, trypsin domain / Trypsin / Trypsin-like serine proteases ...Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, serine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin family, serine active site. / Serine proteases, trypsin domain profile. / Trypsin-like serine protease / Serine proteases, trypsin domain / Trypsin / Trypsin-like serine proteases / Thrombin, subunit H / Peptidase S1, PA clan, chymotrypsin-like fold / Peptidase S1, PA clan / Beta Barrel / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 2.23 Å フーリエ合成 / 解像度: 2.23 Å |
|---|
| Model details | The compound is a competitive non-nucleotide inhibitor binding to the active site |
|---|
 データ登録者 データ登録者 | Hanke, S. / Strater, N. |
|---|
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2020 ジャーナル: J.Med.Chem. / 年: 2020
タイトル: Structural Studies on the Inhibitory Binding Mode of Aromatic Coumarinic Esters to Human Kallikrein-Related Peptidase 7.
著者: Hanke, S. / Tindall, C.A. / Pippel, J. / Ulbricht, D. / Pirotte, B. / Reboud-Ravaux, M. / Heiker, J.T. / Strater, N. |
|---|
| 履歴 | | 登録 | 2020年2月23日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2020年5月20日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年6月24日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation.title / _citation_author.name |
|---|
| 改定 1.2 | 2024年1月24日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.3 | 2024年10月16日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature
Item: _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 2.23 Å
フーリエ合成 / 解像度: 2.23 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Med.Chem. / 年: 2020
ジャーナル: J.Med.Chem. / 年: 2020 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6y4s.cif.gz
6y4s.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6y4s.ent.gz
pdb6y4s.ent.gz PDB形式
PDB形式 6y4s.json.gz
6y4s.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6y4s_validation.pdf.gz
6y4s_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6y4s_full_validation.pdf.gz
6y4s_full_validation.pdf.gz 6y4s_validation.xml.gz
6y4s_validation.xml.gz 6y4s_validation.cif.gz
6y4s_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/y4/6y4s
https://data.pdbj.org/pub/pdb/validation_reports/y4/6y4s ftp://data.pdbj.org/pub/pdb/validation_reports/y4/6y4s
ftp://data.pdbj.org/pub/pdb/validation_reports/y4/6y4s リンク
リンク 集合体
集合体


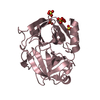
 要素
要素 Homo sapiens (ヒト) / 遺伝子: KLK7, PRSS6, SCCE / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: KLK7, PRSS6, SCCE / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  BESSY
BESSY  / ビームライン: 14.1 / 波長: 0.9184 Å
/ ビームライン: 14.1 / 波長: 0.9184 Å 解析
解析 フーリエ合成
フーリエ合成 ムービー
ムービー コントローラー
コントローラー




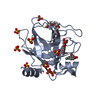











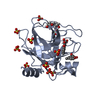
 PDBj
PDBj






