+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5irz | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of TRPV1 determined in lipid nanodisc | |||||||||||||||
 要素 要素 | Transient receptor potential cation channel subfamily V member 1 | |||||||||||||||
 キーワード キーワード | TRANSPORT PROTEIN / TRP / ion channel / nanodisc / vanilloid / lipid | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of establishment of blood-brain barrier / response to capsazepine / sensory perception of mechanical stimulus / peptide secretion / cellular response to temperature stimulus / excitatory extracellular ligand-gated monoatomic ion channel activity / temperature-gated ion channel activity / detection of chemical stimulus involved in sensory perception of pain / TRP channels / smooth muscle contraction involved in micturition ...negative regulation of establishment of blood-brain barrier / response to capsazepine / sensory perception of mechanical stimulus / peptide secretion / cellular response to temperature stimulus / excitatory extracellular ligand-gated monoatomic ion channel activity / temperature-gated ion channel activity / detection of chemical stimulus involved in sensory perception of pain / TRP channels / smooth muscle contraction involved in micturition / fever generation / urinary bladder smooth muscle contraction / detection of temperature stimulus involved in thermoception / thermoception / cellular response to acidic pH / negative regulation of systemic arterial blood pressure / chloride channel regulator activity / response to pH / dendritic spine membrane / glutamate secretion / monoatomic cation transmembrane transporter activity / negative regulation of heart rate / ligand-gated monoatomic ion channel activity / response to pain / temperature homeostasis / diet induced thermogenesis / cellular response to alkaloid / cellular response to ATP / cellular response to cytokine stimulus / detection of temperature stimulus involved in sensory perception of pain / intracellularly gated calcium channel activity / behavioral response to pain / negative regulation of mitochondrial membrane potential / calcium ion import across plasma membrane / monoatomic cation channel activity / extracellular ligand-gated monoatomic ion channel activity / sensory perception of pain / phosphatidylinositol binding / phosphoprotein binding / microglial cell activation / response to peptide hormone / cellular response to nerve growth factor stimulus / calcium ion transmembrane transport / GABA-ergic synapse / cellular response to growth factor stimulus / calcium channel activity / lipid metabolic process / positive regulation of nitric oxide biosynthetic process / calcium ion transport / cellular response to tumor necrosis factor / transmembrane signaling receptor activity / sensory perception of taste / cellular response to heat / positive regulation of cytosolic calcium ion concentration / response to heat / monoatomic ion transmembrane transport / protein homotetramerization / postsynaptic membrane / calmodulin binding / neuron projection / positive regulation of apoptotic process / external side of plasma membrane / neuronal cell body / dendrite / negative regulation of transcription by RNA polymerase II / ATP binding / metal ion binding / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  | |||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.28 Å | |||||||||||||||
 データ登録者 データ登録者 | Gao, Y. / Cao, E. / Julius, D. / Cheng, Y. | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2016 ジャーナル: Nature / 年: 2016タイトル: TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action. 著者: Yuan Gao / Erhu Cao / David Julius / Yifan Cheng /  要旨: When integral membrane proteins are visualized in detergents or other artificial systems, an important layer of information is lost regarding lipid interactions and their effects on protein structure. ...When integral membrane proteins are visualized in detergents or other artificial systems, an important layer of information is lost regarding lipid interactions and their effects on protein structure. This is especially relevant to proteins for which lipids have both structural and regulatory roles. Here we demonstrate the power of combining electron cryo-microscopy with lipid nanodisc technology to ascertain the structure of the rat TRPV1 ion channel in a native bilayer environment. Using this approach, we determined the locations of annular and regulatory lipids and showed that specific phospholipid interactions enhance binding of a spider toxin to TRPV1 through formation of a tripartite complex. Furthermore, phosphatidylinositol lipids occupy the binding site for capsaicin and other vanilloid ligands, suggesting a mechanism whereby chemical or thermal stimuli elicit channel activation by promoting the release of bioactive lipids from a critical allosteric regulatory site. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5irz.cif.gz 5irz.cif.gz | 319.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5irz.ent.gz pdb5irz.ent.gz | 246.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5irz.json.gz 5irz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5irz_validation.pdf.gz 5irz_validation.pdf.gz | 2.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5irz_full_validation.pdf.gz 5irz_full_validation.pdf.gz | 2.2 MB | 表示 | |
| XML形式データ |  5irz_validation.xml.gz 5irz_validation.xml.gz | 61.8 KB | 表示 | |
| CIF形式データ |  5irz_validation.cif.gz 5irz_validation.cif.gz | 86.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ir/5irz https://data.pdbj.org/pub/pdb/validation_reports/ir/5irz ftp://data.pdbj.org/pub/pdb/validation_reports/ir/5irz ftp://data.pdbj.org/pub/pdb/validation_reports/ir/5irz | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
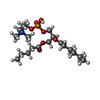
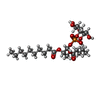
| #1: タンパク質 | 分子量: 72959.297 Da / 分子数: 4 / 断片: UNP residues 110-603, 627-764 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 参照: UniProt: O35433 Homo sapiens (ヒト) / 参照: UniProt: O35433#2: 化合物 | ChemComp-6O8 / ( #3: 化合物 | ChemComp-6ES / ( #4: 化合物 | ChemComp-6OE / ( |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: TRPV1 ion channel in unliganded state / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) | 生物種:  | ||||||||||||||||||||
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) / プラスミド: unknown Homo sapiens (ヒト) / プラスミド: unknown | ||||||||||||||||||||
| 緩衝液 | pH: 7.4 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 0.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: This sample was monodisperse. | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK III / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 278 K 詳細: Blot for 6 seconds before plunging into liquid ethane (FEI VITROBOT MARK III). |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI POLARA 300 / 詳細: Grid screening was performed manually. |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 31000 X / 倍率(補正後): 41132 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 700 nm / Calibrated defocus min: 700 nm / 最大 デフォーカス(補正後): 2200 nm / Cs: 2 mm / C2レンズ絞り径: 30 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN / 試料ホルダーモデル: OTHER / 最高温度: 70 K / 最低温度: 70 K |
| 撮影 | 平均露光時間: 6 sec. / 電子線照射量: 41 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 1 / 実像数: 1000 詳細: Images were collected in movie mode at 5 frames per second for 6 seconds. |
| 画像スキャン | 横: 3838 / 縦: 3710 / 動画フレーム数/画像: 30 / 利用したフレーム数/画像: 1-30 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.10_2152: / 分類: 精密化 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 画像処理 | 詳細: Each image stack was subjected to whole-frame motion correction followed by correction at the individual pixel level using program UcsfDfCorr. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CTF補正 | 詳細: CTF correction was performed before classification and refinement. タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 159193 詳細: Initial manual particle picking and automatic particle picking were performed using SamViewer and several python scripts based on SPIDER. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C4 (4回回転対称) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.28 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 30689 / クラス平均像の数: 1 / 対称性のタイプ: POINT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL / Target criteria: correlation coefficient | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 3J5P PDB chain-ID: A / Accession code: 3J5P / Source name: PDB / タイプ: experimental model | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 最高解像度: 3.28 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj