| 登録情報 | データベース: PDB / ID: 5i4z
|
|---|
| タイトル | Structure of apo OmoMYC |
|---|
 要素 要素 | Myc proto-oncogene protein |
|---|
 キーワード キーワード | TRANSCRIPTION / leucine zipper / transcription factor / tumor suppressor / E-box |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
positive regulation of metanephric cap mesenchymal cell proliferation / positive regulation of acinar cell proliferation / acinar cell proliferation / negative regulation of transcription initiation by RNA polymerase II / SCF ubiquitin ligase complex binding / NK T cell proliferation / Myc-Max complex / regulation of somatic stem cell population maintenance / regulation of cell cycle process / Binding of TCF/LEF:CTNNB1 to target gene promoters ...positive regulation of metanephric cap mesenchymal cell proliferation / positive regulation of acinar cell proliferation / acinar cell proliferation / negative regulation of transcription initiation by RNA polymerase II / SCF ubiquitin ligase complex binding / NK T cell proliferation / Myc-Max complex / regulation of somatic stem cell population maintenance / regulation of cell cycle process / Binding of TCF/LEF:CTNNB1 to target gene promoters / cellular response to interferon-alpha / RNA polymerase II transcription repressor complex / myotube differentiation / positive regulation of B cell apoptotic process / RUNX3 regulates WNT signaling / TFAP2 (AP-2) family regulates transcription of cell cycle factors / negative regulation of cell division / negative regulation of monocyte differentiation / detection of mechanical stimulus involved in sensory perception of sound / response to growth factor / response to alkaloid / B cell apoptotic process / transcription regulator activator activity / protein-DNA complex disassembly / Transcription of E2F targets under negative control by DREAM complex / negative regulation of stress-activated MAPK cascade / fibroblast apoptotic process / Regulation of NFE2L2 gene expression / regulation of telomere maintenance / positive regulation of mesenchymal cell proliferation / middle ear morphogenesis / skeletal system morphogenesis / Signaling by ALK / branching involved in ureteric bud morphogenesis / negative regulation of gene expression via chromosomal CpG island methylation / pigmentation / rRNA metabolic process / E-box binding / positive regulation of telomere maintenance / skeletal muscle cell differentiation / positive regulation of intrinsic apoptotic signaling pathway by p53 class mediator / positive regulation of transcription initiation by RNA polymerase II / chromosome organization / negative regulation of fibroblast proliferation / core promoter sequence-specific DNA binding / Cyclin E associated events during G1/S transition / Cyclin A:Cdk2-associated events at S phase entry / ERK1 and ERK2 cascade / positive regulation of epithelial cell proliferation / transcription coregulator binding / SMAD2/SMAD3:SMAD4 heterotrimer regulates transcription / euchromatin / G1/S transition of mitotic cell cycle / MAPK6/MAPK4 signaling / protein processing / NOTCH1 Intracellular Domain Regulates Transcription / positive regulation of miRNA transcription / Constitutive Signaling by NOTCH1 PEST Domain Mutants / Constitutive Signaling by NOTCH1 HD+PEST Domain Mutants / DNA-binding transcription repressor activity, RNA polymerase II-specific / spindle / Wnt signaling pathway / cellular response to xenobiotic stimulus / Transcriptional regulation of granulopoiesis / positive regulation of fibroblast proliferation / intrinsic apoptotic signaling pathway in response to DNA damage / cellular response to UV / MAPK cascade / regulation of gene expression / DNA-binding transcription activator activity, RNA polymerase II-specific / Interleukin-4 and Interleukin-13 signaling / cellular response to hypoxia / Estrogen-dependent gene expression / DNA-binding transcription factor binding / intracellular iron ion homeostasis / transcription by RNA polymerase II / DNA-binding transcription factor activity, RNA polymerase II-specific / protein dimerization activity / Ub-specific processing proteases / nuclear body / RNA polymerase II cis-regulatory region sequence-specific DNA binding / chromatin remodeling / response to xenobiotic stimulus / axon / positive regulation of cell population proliferation / DNA damage response / ubiquitin protein ligase binding / positive regulation of gene expression / regulation of transcription by RNA polymerase II / negative regulation of apoptotic process / chromatin / protein-containing complex binding / positive regulation of DNA-templated transcription / nucleolus / perinuclear region of cytoplasm / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / protein-containing complex / DNA binding / nucleoplasm類似検索 - 分子機能 Leucine zipper, Myc / Myc leucine zipper domain / Transcription regulator Myc / Transcription regulator Myc, N-terminal / : / Myc amino-terminal region / Helix-loop-helix DNA-binding domain / MYOD Basic-Helix-Loop-Helix Domain, subunit B / Helix-loop-helix DNA-binding domain / helix loop helix domain ...Leucine zipper, Myc / Myc leucine zipper domain / Transcription regulator Myc / Transcription regulator Myc, N-terminal / : / Myc amino-terminal region / Helix-loop-helix DNA-binding domain / MYOD Basic-Helix-Loop-Helix Domain, subunit B / Helix-loop-helix DNA-binding domain / helix loop helix domain / Myc-type, basic helix-loop-helix (bHLH) domain / Myc-type, basic helix-loop-helix (bHLH) domain profile. / Helix-loop-helix DNA-binding domain superfamily / Few Secondary Structures / Irregular類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.95 Å 分子置換 / 解像度: 1.95 Å |
|---|
 データ登録者 データ登録者 | Koelmel, W. / Jung, L.A. / Kuper, J. / Eilers, M. / Kisker, C. |
|---|
| 資金援助 |  ドイツ, 1件 ドイツ, 1件 | 組織 | 認可番号 | 国 |
|---|
| German Research Foundation | 2341 |  ドイツ ドイツ |
|
|---|
 引用 引用 |  ジャーナル: Oncogene / 年: 2017 ジャーナル: Oncogene / 年: 2017
タイトル: OmoMYC blunts promoter invasion by oncogenic MYC to inhibit gene expression characteristic of MYC-dependent tumors.
著者: Jung, L.A. / Gebhardt, A. / Koelmel, W. / Ade, C.P. / Walz, S. / Kuper, J. / von Eyss, B. / Letschert, S. / Redel, C. / d'Artista, L. / Biankin, A. / Zender, L. / Sauer, M. / Wolf, E. / Evan, ...著者: Jung, L.A. / Gebhardt, A. / Koelmel, W. / Ade, C.P. / Walz, S. / Kuper, J. / von Eyss, B. / Letschert, S. / Redel, C. / d'Artista, L. / Biankin, A. / Zender, L. / Sauer, M. / Wolf, E. / Evan, G. / Kisker, C. / Eilers, M. |
|---|
| 履歴 | | 登録 | 2016年2月13日 | 登録サイト: RCSB / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2016年10月26日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2017年4月19日 | Group: Database references |
|---|
| 改定 1.2 | 2024年1月10日 | Group: Author supporting evidence / Data collection ...Author supporting evidence / Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_audit_support / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_audit_support.funding_organization / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr1_symmetry / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.ptnr3_symmetry / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_symmetry |
|---|
| 改定 1.3 | 2024年11月20日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.95 Å
分子置換 / 解像度: 1.95 Å  データ登録者
データ登録者 ドイツ, 1件
ドイツ, 1件  引用
引用 ジャーナル: Oncogene / 年: 2017
ジャーナル: Oncogene / 年: 2017 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5i4z.cif.gz
5i4z.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5i4z.ent.gz
pdb5i4z.ent.gz PDB形式
PDB形式 5i4z.json.gz
5i4z.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5i4z_validation.pdf.gz
5i4z_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5i4z_full_validation.pdf.gz
5i4z_full_validation.pdf.gz 5i4z_validation.xml.gz
5i4z_validation.xml.gz 5i4z_validation.cif.gz
5i4z_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/i4/5i4z
https://data.pdbj.org/pub/pdb/validation_reports/i4/5i4z ftp://data.pdbj.org/pub/pdb/validation_reports/i4/5i4z
ftp://data.pdbj.org/pub/pdb/validation_reports/i4/5i4z リンク
リンク 集合体
集合体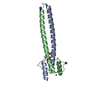
 要素
要素 Homo sapiens (ヒト) / 遺伝子: MYC, BHLHE39 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: MYC, BHLHE39 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID23-1 / 波長: 1.064 Å
/ ビームライン: ID23-1 / 波長: 1.064 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj


















