+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2j37 | ||||||
|---|---|---|---|---|---|---|---|
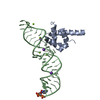
| Title | MODEL OF MAMMALIAN SRP BOUND TO 80S RNCS | ||||||
 Components Components |
| ||||||
 Keywords Keywords | RIBOSOME / SRP / TRANSLATION/RNA | ||||||
| Function / homology |  Function and homology information Function and homology informationSRP-dependent cotranslational protein targeting to membrane / SRP-dependent cotranslational protein targeting to membrane, signal sequence recognition / endoplasmic reticulum signal peptide binding / signal recognition particle, endoplasmic reticulum targeting / response to high light intensity / signal recognition particle / cotranslational protein targeting to membrane / granulocyte differentiation / signal-recognition-particle GTPase / protein targeting to ER ...SRP-dependent cotranslational protein targeting to membrane / SRP-dependent cotranslational protein targeting to membrane, signal sequence recognition / endoplasmic reticulum signal peptide binding / signal recognition particle, endoplasmic reticulum targeting / response to high light intensity / signal recognition particle / cotranslational protein targeting to membrane / granulocyte differentiation / signal-recognition-particle GTPase / protein targeting to ER / SRP-dependent cotranslational protein targeting to membrane, translocation / 7S RNA binding / exocrine pancreas development / phototransduction / SRP-dependent cotranslational protein targeting to membrane / ribonucleoprotein complex binding / neutrophil chemotaxis / visual perception / chloroplast / maturation of LSU-rRNA from tricistronic rRNA transcript (SSU-rRNA, 5.8S rRNA, LSU-rRNA) / G protein-coupled receptor activity / GDP binding / cytosolic large ribosomal subunit / rRNA binding / nuclear speck / nuclear body / structural constituent of ribosome / ribosome / translation / ribonucleoprotein complex / GTPase activity / mRNA binding / GTP binding / nucleolus / endoplasmic reticulum / ATP hydrolysis activity / RNA binding / membrane / nucleus / cytosol Similarity search - Function | ||||||
| Biological species |     HOMO SAPIENS (human) HOMO SAPIENS (human) HALOARCULA MARISMORTUI (Halophile) HALOARCULA MARISMORTUI (Halophile) | ||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 8.7 Å | ||||||
 Authors Authors | Halic, M. / Blau, M. / Becker, T. / Mielke, T. / Pool, M.R. / Wild, K. / Sinning, I. / Beckmann, R. | ||||||
 Citation Citation |  Journal: Nature / Year: 2006 Journal: Nature / Year: 2006Title: Following the signal sequence from ribosomal tunnel exit to signal recognition particle. Authors: Mario Halic / Michael Blau / Thomas Becker / Thorsten Mielke / Martin R Pool / Klemens Wild / Irmgard Sinning / Roland Beckmann /  Abstract: Membrane and secretory proteins can be co-translationally inserted into or translocated across the membrane. This process is dependent on signal sequence recognition on the ribosome by the signal ...Membrane and secretory proteins can be co-translationally inserted into or translocated across the membrane. This process is dependent on signal sequence recognition on the ribosome by the signal recognition particle (SRP), which results in targeting of the ribosome-nascent-chain complex to the protein-conducting channel at the membrane. Here we present an ensemble of structures at subnanometre resolution, revealing the signal sequence both at the ribosomal tunnel exit and in the bacterial and eukaryotic ribosome-SRP complexes. Molecular details of signal sequence interaction in both prokaryotic and eukaryotic complexes were obtained by fitting high-resolution molecular models. The signal sequence is presented at the ribosomal tunnel exit in an exposed position ready for accommodation in the hydrophobic groove of the rearranged SRP54 M domain. Upon ribosome binding, the SRP54 NG domain also undergoes a conformational rearrangement, priming it for the subsequent docking reaction with the NG domain of the SRP receptor. These findings provide the structural basis for improving our understanding of the early steps of co-translational protein sorting. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2j37.cif.gz 2j37.cif.gz | 390.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2j37.ent.gz pdb2j37.ent.gz | 291.9 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2j37.json.gz 2j37.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/j3/2j37 https://data.pdbj.org/pub/pdb/validation_reports/j3/2j37 ftp://data.pdbj.org/pub/pdb/validation_reports/j3/2j37 ftp://data.pdbj.org/pub/pdb/validation_reports/j3/2j37 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  1264MC  1261C  1262C  1263C  2j28C C: citing same article ( M: map data used to model this data |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
-RIBOSOMAL PROTEIN ... , 2 types, 2 molecules 56
| #2: Protein | Mass: 14401.041 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
|---|---|
| #3: Protein | Mass: 14152.365 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
-RNA chain , 2 types, 2 molecules AZ
| #4: RNA chain | Mass: 41504.750 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
|---|---|
| #8: RNA chain | Mass: 90695.906 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  HALOARCULA MARISMORTUI (Halophile) HALOARCULA MARISMORTUI (Halophile) |
-SIGNAL RECOGNITION PARTICLE ... , 2 types, 2 molecules BW
| #5: Protein | Mass: 12561.688 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  HOMO SAPIENS (human) / References: UniProt: P09132 HOMO SAPIENS (human) / References: UniProt: P09132 |
|---|---|
| #7: Protein | Mass: 55775.672 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
-Protein / Protein/peptide , 2 types, 2 molecules 4S
| #1: Protein | Mass: 16920.203 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
|---|---|
| #6: Protein/peptide | Mass: 1992.362 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: SRP BOUND TO 80S RNCS / Type: RIBOSOME |
|---|---|
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES |
| Specimen support | Details: CARBON |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Tecnai F30 / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TECNAI F30 |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal defocus max: 3000 nm / Nominal defocus min: 900 nm |
| Image recording | Electron dose: 20 e/Å2 / Film or detector model: KODAK SO-163 FILM |
- Processing
Processing
| Symmetry | Point symmetry: C1 (asymmetric) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3D reconstruction | Resolution: 8.7 Å / Resolution method: FSC 0.5 CUT-OFF / Symmetry type: POINT | ||||||||||||
| Refinement | Highest resolution: 8.7 Å | ||||||||||||
| Refinement step | Cycle: LAST / Highest resolution: 8 Å
|
 Movie
Movie Controller
Controller















 PDBj
PDBj







































