+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1qom | ||||||
|---|---|---|---|---|---|---|---|
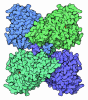
| タイトル | MURINE INDUCIBLE NITRIC OXIDE SYNTHASE OXYGENASE DIMER (DELTA 65) WITH SWAPPED N-TERMINAL HOOK | ||||||
 要素 要素 | NITRIC OXIDE SYNTHASE | ||||||
 キーワード キーワード | OXIDOREDUCTASE / NITRIC OXIDE MONOOXYGENASE / HEME / DIMER / NOS / SWAPPED N- TERMINAL HOOK / DISULFIDE (OXIDOREDUCTASE/SUBSTRATE) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Nitric oxide stimulates guanylate cyclase / ROS and RNS production in phagocytes / peptidyl-cysteine S-nitrosylation / Peroxisomal protein import / prostaglandin secretion / tetrahydrobiopterin binding / arginine binding / superoxide metabolic process / cortical cytoskeleton / regulation of cytokine production involved in inflammatory response ...Nitric oxide stimulates guanylate cyclase / ROS and RNS production in phagocytes / peptidyl-cysteine S-nitrosylation / Peroxisomal protein import / prostaglandin secretion / tetrahydrobiopterin binding / arginine binding / superoxide metabolic process / cortical cytoskeleton / regulation of cytokine production involved in inflammatory response / cellular response to cytokine stimulus / Fc-gamma receptor signaling pathway involved in phagocytosis / nitric-oxide synthase (NADPH) / nitric-oxide synthase activity / L-arginine catabolic process / nitric oxide biosynthetic process / regulation of insulin secretion / positive regulation of interleukin-8 production / response to bacterium / negative regulation of protein catabolic process / circadian rhythm / cellular response to type II interferon / positive regulation of interleukin-6 production / cellular response to xenobiotic stimulus / peroxisome / FMN binding / flavin adenine dinucleotide binding / NADP binding / regulation of cell population proliferation / cellular response to lipopolysaccharide / response to lipopolysaccharide / calmodulin binding / response to hypoxia / defense response to bacterium / inflammatory response / negative regulation of gene expression / heme binding / perinuclear region of cytoplasm / protein homodimerization activity / metal ion binding / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / OTHER / 解像度: 2.7 Å シンクロトロン / OTHER / 解像度: 2.7 Å | ||||||
 データ登録者 データ登録者 | Crane, B.R. / Rosenfeld, R.A. / Arvai, A.S. / Tainer, J.A. / Stuehr, D.J. / Getzoff, E.D. | ||||||
 引用 引用 |  ジャーナル: Embo J. / 年: 1999 ジャーナル: Embo J. / 年: 1999タイトル: N-Terminal Domain Swapping and Metal Ion Binding in Nitric Oxide Synthase Dimerization 著者: Crane, B.R. / Rosenfeld, R.A. / Arvai, A.S. / Ghosh, D.K. / Ghosh, S. / Tainer, J.A. / Stuehr, D.J. / Getzoff, E.D. #1: ジャーナル: Embo J. / 年: 1999 タイトル: Inducible Nitric Oxide Synthase: Role of the N-Terminal Beta-Hairpin Hook and Pterin-Binding Segment in Dimerization and Tetrahydrobiopterin Interaction 著者: Ghosh, D.K. / Crane, B.R. / Ghosh, S. / Wolan, D. / Gachhui, R. / Crooks, C. / Presta, A. / Tainer, J.A. / Getzoff, E.D. / Stuehr, D.J. #2:  ジャーナル: Science / 年: 1998 ジャーナル: Science / 年: 1998タイトル: Structure of Nitric Oxide Synthase Oxygenase Dimer with Pterin and Substrate 著者: Crane, B.R. / Arvai, A.S. / Ghosh, D.K. / Wu, C. / Getzoff, E.D. / Stuehr, D.J. / Tainer, J.A. #3:  ジャーナル: Science / 年: 1997 ジャーナル: Science / 年: 1997タイトル: The Structure of Nitric Oxide Synthase Oxygenase Domain and Inhibitor Complexes 著者: Crane, B.R. / Arvai, A.S. / Gachhui, R. / Wu, C. / Ghosh, D.K. / Getzoff, E.D. / Stuehr, D.J. / Tainer, J.A. | ||||||
| 履歴 |
| ||||||
| Remark 700 | SHEET DETERMINATION METHOD: KABSCH AND SANDER |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1qom.cif.gz 1qom.cif.gz | 194.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1qom.ent.gz pdb1qom.ent.gz | 154.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1qom.json.gz 1qom.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1qom_validation.pdf.gz 1qom_validation.pdf.gz | 595.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1qom_full_validation.pdf.gz 1qom_full_validation.pdf.gz | 618.2 KB | 表示 | |
| XML形式データ |  1qom_validation.xml.gz 1qom_validation.xml.gz | 21.3 KB | 表示 | |
| CIF形式データ |  1qom_validation.cif.gz 1qom_validation.cif.gz | 32.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qo/1qom https://data.pdbj.org/pub/pdb/validation_reports/qo/1qom ftp://data.pdbj.org/pub/pdb/validation_reports/qo/1qom ftp://data.pdbj.org/pub/pdb/validation_reports/qo/1qom | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||||||||||||||
| 2 | 
| |||||||||||||||||||||
| 単位格子 |
| |||||||||||||||||||||
| Components on special symmetry positions |
| |||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper:
|
- 要素
要素
| #1: タンパク質 | 分子量: 51036.898 Da / 分子数: 2 / 断片: OXYGENASE DOMAIN, RESIDUES 65-498 / 由来タイプ: 組換発現 / 詳細: MURINE INDUCIBLE / 由来: (組換発現)   #2: 化合物 | #3: 化合物 | #4: 水 | ChemComp-HOH / | 構成要素の詳細 | PROTEIN WAS EXPRESSED WITH A COOH-TERMINAL HIS6 TAG. | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 4 Å3/Da / 溶媒含有率: 70 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法 / pH: 6 / 詳細: pH 6.00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶 | *PLUS 溶媒含有率: 70 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 4 ℃ / pH: 7.6 / 手法: 蒸気拡散法 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SSRL SSRL  / ビームライン: BL7-1 / 波長: 1.08 / ビームライン: BL7-1 / 波長: 1.08 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1997年9月15日 / 詳細: PT MIRROR |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.08 Å / 相対比: 1 |
| 反射 | 解像度: 2.7→20 Å / Num. obs: 39200 / % possible obs: 91.7 % / Observed criterion σ(I): 0 / 冗長度: 3.9 % / Biso Wilson estimate: 68.2 Å2 / Rsym value: 0.059 / Net I/σ(I): 17 |
| 反射 シェル | 解像度: 2.7→2.8 Å / 冗長度: 3 % / Mean I/σ(I) obs: 2.9 / Rsym value: 0.362 / % possible all: 92.3 |
| 反射 | *PLUS Num. measured all: 153562 / Rmerge(I) obs: 0.059 |
| 反射 シェル | *PLUS % possible obs: 92.3 % / Num. unique obs: 4290 / Num. measured obs: 12662 / Rmerge(I) obs: 0.362 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法: OTHER / 解像度: 2.7→20 Å / Rfactor Rfree error: 0.007 / Data cutoff high absF: 11313090.24 / Data cutoff low absF: 0 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 75.6 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.7→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | Rms dev Biso : 2.1 Å2 / Rms dev position: 0.04 Å / Weight Biso : 0.95 / Weight position: 100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.7→2.87 Å / Rfactor Rfree error: 0.024 / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.8 / 分類: refinement X-PLOR / バージョン: 3.8 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS Rfactor all: 0.236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS Rfactor obs: 0.372 |
 ムービー
ムービー コントローラー
コントローラー





























 PDBj
PDBj