+ Open data
Open data
- Basic information
Basic information
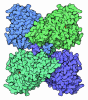
| Entry | Database: PDB / ID: 1nsi | ||||||
|---|---|---|---|---|---|---|---|
| Title | HUMAN INDUCIBLE NITRIC OXIDE SYNTHASE, ZN-BOUND, L-ARG COMPLEX | ||||||
 Components Components | PROTEIN (NITRIC OXIDE SYNTHASE) | ||||||
 Keywords Keywords | OXIDOREDUCTASE / NITRIC OXIDE SYNTHASE / HEME PROTEIN / TETRAHYDROBIOPTERIN | ||||||
| Function / homology |  Function and homology information Function and homology informationpositive regulation of leukocyte mediated cytotoxicity / Inhibition of nitric oxide production / peptidyl-cysteine S-nitrosylation / regulation of cellular respiration / Nitric oxide stimulates guanylate cyclase / prostaglandin secretion / ROS and RNS production in phagocytes / tetrahydrobiopterin binding / arginine binding / superoxide metabolic process ...positive regulation of leukocyte mediated cytotoxicity / Inhibition of nitric oxide production / peptidyl-cysteine S-nitrosylation / regulation of cellular respiration / Nitric oxide stimulates guanylate cyclase / prostaglandin secretion / ROS and RNS production in phagocytes / tetrahydrobiopterin binding / arginine binding / superoxide metabolic process / regulation of cytokine production involved in inflammatory response / Fc-gamma receptor signaling pathway involved in phagocytosis / cortical cytoskeleton / peroxisomal matrix / nitric oxide mediated signal transduction / nitric-oxide synthase (NADPH) / nitric-oxide synthase activity / L-arginine catabolic process / negative regulation of blood pressure / response to hormone / nitric oxide biosynthetic process / regulation of insulin secretion / cell redox homeostasis / positive regulation of interleukin-8 production / innate immune response in mucosa / response to bacterium / Peroxisomal protein import / circadian rhythm / negative regulation of protein catabolic process / positive regulation of interleukin-6 production / cellular response to type II interferon / cellular response to xenobiotic stimulus / peroxisome / FMN binding / NADP binding / flavin adenine dinucleotide binding / regulation of cell population proliferation / cellular response to lipopolysaccharide / Interleukin-4 and Interleukin-13 signaling / response to lipopolysaccharide / defense response to Gram-negative bacterium / response to hypoxia / calmodulin binding / defense response to bacterium / inflammatory response / negative regulation of gene expression / heme binding / perinuclear region of cytoplasm / protein homodimerization activity / nucleoplasm / metal ion binding / nucleus / plasma membrane / cytoplasm / cytosol Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.55 Å MOLECULAR REPLACEMENT / Resolution: 2.55 Å | ||||||
 Authors Authors | Li, H. / Raman, C.S. / Glaser, C.B. / Blasko, E. / Young, T.A. / Parkinson, J.F. / Whitlow, M. / Poulos, T.L. | ||||||
 Citation Citation |  Journal: J.Biol.Chem. / Year: 1999 Journal: J.Biol.Chem. / Year: 1999Title: Crystal structures of zinc-free and -bound heme domain of human inducible nitric-oxide synthase. Implications for dimer stability and comparison with endothelial nitric-oxide synthase. Authors: Li, H. / Raman, C.S. / Glaser, C.B. / Blasko, E. / Young, T.A. / Parkinson, J.F. / Whitlow, M. / Poulos, T.L. #1:  Journal: Science / Year: 1998 Journal: Science / Year: 1998Title: Structure of Nitric Oxide Synthase Oxygenase Dimer with Pterin and Substrate Authors: Crane, B.R. / Arvai, A.S. / Ghosh, D.K. / Wu, C. / Getzoff, E.D. / Stuehr, D.J. / Tainer, J.A. #2:  Journal: Science / Year: 1997 Journal: Science / Year: 1997Title: The Structure of Nitric Oxide Synthase Oxygenase Domain and Inhibitor Complex Authors: Crane, B.R. / Arvai, A.S. / Gachhui, R. / Wu, C. / Ghosh, D.K. / Getzoff, E.D. / Stuehr, D.J. / Tainer, J.A. #3:  Journal: Cell(Cambridge,Mass.) / Year: 1998 Journal: Cell(Cambridge,Mass.) / Year: 1998Title: Crystal Structure of Constitutive Endothelial Nitric Oxide Synthase: A Paradigm for Pterin Function Involving a Novel Metal Center Authors: Raman, C.S. / Li, H. / Martasek, P. / Kral, V. / Masters, B.S. / Poulos, T.L. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1nsi.cif.gz 1nsi.cif.gz | 359.1 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1nsi.ent.gz pdb1nsi.ent.gz | 293.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1nsi.json.gz 1nsi.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ns/1nsi https://data.pdbj.org/pub/pdb/validation_reports/ns/1nsi ftp://data.pdbj.org/pub/pdb/validation_reports/ns/1nsi ftp://data.pdbj.org/pub/pdb/validation_reports/ns/1nsi | HTTPS FTP |
|---|
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||
| 2 | 
| ||||||||||||||||
| Unit cell |
| ||||||||||||||||
| Noncrystallographic symmetry (NCS) | NCS oper:
|
- Components
Components
-Protein , 1 types, 4 molecules ABCD
| #1: Protein | Mass: 49705.531 Da / Num. of mol.: 4 / Fragment: HEME DOMAIN Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Cell: ADENOCARCINOMA DLD-1 / Production host: Homo sapiens (human) / Cell: ADENOCARCINOMA DLD-1 / Production host:  |
|---|
-Non-polymers , 7 types, 322 molecules 










| #2: Chemical | ChemComp-SO4 / #3: Chemical | #4: Chemical | ChemComp-HEM / #5: Chemical | ChemComp-H4B / #6: Chemical | ChemComp-ARG / #7: Chemical | ChemComp-GOL / #8: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density % sol: 78 % / Description: ONE DIMER AS THE SEARCH MODEL | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | pH: 5 / Details: pH 5.0 | |||||||||||||||||||||||||||||||||||
| Crystal grow | *PLUS Temperature: 7 ℃ / Method: vapor diffusion, sitting drop | |||||||||||||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  ALS ALS  / Beamline: 5.0.2 / Wavelength: 1 / Beamline: 5.0.2 / Wavelength: 1 |
| Detector | Type: ADSC / Detector: CCD / Date: Aug 15, 1998 / Details: MIRROR |
| Radiation | Monochromator: YES / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1 Å / Relative weight: 1 |
| Reflection | Resolution: 2.55→50 Å / Num. obs: 125717 / % possible obs: 95.9 % / Observed criterion σ(I): -3 / Redundancy: 3.8 % / Biso Wilson estimate: 63.5 Å2 / Rsym value: 0.052 / Net I/σ(I): 12.2 |
| Reflection shell | Resolution: 2.55→2.59 Å / Redundancy: 2.7 % / Mean I/σ(I) obs: 2.3 / Rsym value: 0.488 / % possible all: 71.2 |
| Reflection | *PLUS Num. measured all: 477621 / Rmerge(I) obs: 0.052 |
| Reflection shell | *PLUS % possible obs: 71.2 % / Rmerge(I) obs: 0.488 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: ENOS HEME DOMAIN Resolution: 2.55→30 Å / Data cutoff high absF: 10000000 / Data cutoff low absF: 0.001 / Cross valid method: THROUGHOUT / σ(F): 2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.55→30 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.55→2.67 Å / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Software | *PLUS Name:  X-PLOR / Version: 3.8 / Classification: refinement X-PLOR / Version: 3.8 / Classification: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints | *PLUS
|
 Movie
Movie Controller
Controller
























 PDBj
PDBj