+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human FL Metabotropic glutamate receptor 5, mGlu5-5M with quisqualate and PAM VU29 | ||||||||||||
 マップデータ マップデータ | Combined map sharpened with B=-20 | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | G-PROTEIN COUPLED RECEPTORS / SIGNAL TRANSDUCTION / METABOTROPIC GLUTAMATE RECEPTOR / Agonist / active state / MEMBRANE PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報A2A adenosine receptor binding / neurotransmitter receptor activity involved in regulation of postsynaptic cytosolic calcium ion concentration / G protein-coupled receptor activity involved in regulation of postsynaptic membrane potential / adenylate cyclase inhibiting G protein-coupled glutamate receptor activity / phospholipase C-activating G protein-coupled glutamate receptor signaling pathway / positive regulation of long-term neuronal synaptic plasticity / desensitization of G protein-coupled receptor signaling pathway / G protein-coupled glutamate receptor signaling pathway / Class C/3 (Metabotropic glutamate/pheromone receptors) / glutamate receptor activity ...A2A adenosine receptor binding / neurotransmitter receptor activity involved in regulation of postsynaptic cytosolic calcium ion concentration / G protein-coupled receptor activity involved in regulation of postsynaptic membrane potential / adenylate cyclase inhibiting G protein-coupled glutamate receptor activity / phospholipase C-activating G protein-coupled glutamate receptor signaling pathway / positive regulation of long-term neuronal synaptic plasticity / desensitization of G protein-coupled receptor signaling pathway / G protein-coupled glutamate receptor signaling pathway / Class C/3 (Metabotropic glutamate/pheromone receptors) / glutamate receptor activity / Neurexins and neuroligins / astrocyte projection / protein tyrosine kinase activator activity / regulation of synaptic transmission, glutamatergic / positive regulation of calcium-mediated signaling / protein tyrosine kinase binding / dendritic shaft / learning / locomotory behavior / postsynaptic density membrane / synapse organization / G protein-coupled receptor activity / Schaffer collateral - CA1 synapse / cognition / cellular response to amyloid-beta / G alpha (q) signalling events / dendritic spine / chemical synaptic transmission / learning or memory / positive regulation of MAPK cascade / neuronal cell body / dendrite / regulation of DNA-templated transcription / glutamatergic synapse / identical protein binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | ||||||||||||
 データ登録者 データ登録者 | Vinothkumar KR / Lebon G / Cannone G | ||||||||||||
| 資金援助 |  インド, インド,  フランス, 3件 フランス, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Conformational diversity in class C GPCR positive allosteric modulation. 著者: Giuseppe Cannone / Ludovic Berto / Fanny Malhaire / Gavin Ferguson / Aurelien Fouillen / Stéphanie Balor / Joan Font-Ingles / Amadeu Llebaria / Cyril Goudet / Abhay Kotecha / Vinothkumar K R ...著者: Giuseppe Cannone / Ludovic Berto / Fanny Malhaire / Gavin Ferguson / Aurelien Fouillen / Stéphanie Balor / Joan Font-Ingles / Amadeu Llebaria / Cyril Goudet / Abhay Kotecha / Vinothkumar K R / Guillaume Lebon /      要旨: The metabotropic glutamate receptors (mGlus) are class C G protein-coupled receptors (GPCR) that form obligate dimers activated by the major excitatory neurotransmitter L-glutamate. The architecture ...The metabotropic glutamate receptors (mGlus) are class C G protein-coupled receptors (GPCR) that form obligate dimers activated by the major excitatory neurotransmitter L-glutamate. The architecture of mGlu receptor comprises an extracellular Venus-Fly Trap domain (VFT) connected to the transmembrane domain (7TM) through a Cysteine-Rich Domain (CRD). The binding of L-glutamate in the VFTs and subsequent conformational change results in the signal being transmitted to the 7TM inducing G protein binding and activation. The mGlu receptors signal transduction can be allosterically potentiated by positive allosteric modulators (PAMs) binding to the 7TMs, which are of therapeutic interest in various neurological disorders. Here, we report the cryoEM structures of metabotropic glutamate receptor 5 (mGlu) purified with three chemically and pharmacologically distinct PAMs. We find that the PAMs modulate the receptor equilibrium through their different binding modes, revealing how their interactions in the 7TMs impact the mGlu receptor conformational landscape and function. In addition, we identified a PAM-free but agonist-bound intermediate state that also reveals interactions mediated by intracellular loop 2. The activation of mGlu receptor is a multi-step process in which the binding of the PAMs in the 7TM modulates the equilibrium towards the active state. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37977.map.gz emd_37977.map.gz | 382.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37977-v30.xml emd-37977-v30.xml emd-37977.xml emd-37977.xml | 22.4 KB 22.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_37977_fsc.xml emd_37977_fsc.xml | 17 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_37977.png emd_37977.png | 92.2 KB | ||
| Filedesc metadata |  emd-37977.cif.gz emd-37977.cif.gz | 7.7 KB | ||
| その他 |  emd_37977_half_map_1.map.gz emd_37977_half_map_1.map.gz emd_37977_half_map_2.map.gz emd_37977_half_map_2.map.gz | 382.1 MB 382.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37977 http://ftp.pdbj.org/pub/emdb/structures/EMD-37977 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37977 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37977 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37977_validation.pdf.gz emd_37977_validation.pdf.gz | 962.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37977_full_validation.pdf.gz emd_37977_full_validation.pdf.gz | 961.7 KB | 表示 | |
| XML形式データ |  emd_37977_validation.xml.gz emd_37977_validation.xml.gz | 24.6 KB | 表示 | |
| CIF形式データ |  emd_37977_validation.cif.gz emd_37977_validation.cif.gz | 32.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37977 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37977 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37977 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37977 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8x0fMC  8x0bC  8x0cC  8x0dC  8x0eC  8x0gC  8x0hC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37977.map.gz / 形式: CCP4 / 大きさ: 411.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37977.map.gz / 形式: CCP4 / 大きさ: 411.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Combined map sharpened with B=-20 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.727 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: One of the half maps
| ファイル | emd_37977_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | One of the half maps | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: One of the half maps
| ファイル | emd_37977_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | One of the half maps | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human FL Metabotropic glutamate receptor 5, mGlu5-5M with quisqua...
| 全体 | 名称: Human FL Metabotropic glutamate receptor 5, mGlu5-5M with quisqualate and VU029 |
|---|---|
| 要素 |
|
-超分子 #1: Human FL Metabotropic glutamate receptor 5, mGlu5-5M with quisqua...
| 超分子 | 名称: Human FL Metabotropic glutamate receptor 5, mGlu5-5M with quisqualate and VU029 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 200 KDa |
-分子 #1: Metabotropic glutamate receptor 5
| 分子 | 名称: Metabotropic glutamate receptor 5 / タイプ: protein_or_peptide / ID: 1 詳細: The construct has tags and protease cleavage site at its N-term (DYKDDDDKHHHHHHHHHHLEVLFQGP) and when compared to uniprot it starts at 21 and ends at 856. For CryoEM, the tag is cleaved and ...詳細: The construct has tags and protease cleavage site at its N-term (DYKDDDDKHHHHHHHHHHLEVLFQGP) and when compared to uniprot it starts at 21 and ends at 856. For CryoEM, the tag is cleaved and the protein used for experiment starts at QSSE but residues starting RR have been modeled. There are 5 thermostabilising mutations (T742A, S753A, T777A, I799A, A813L). Residue N445 is mutated to remove glycosylation. An additional mutation H350L is engineered for a nanobody to bind. Each monomer has one sugar modelled and 10 disulfide bonds. コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 93.691492 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: QSSERRVVAH MPGDIIIGAL FSVHHQPTVD KVHERKCGAV REQYGIQRVE AMLHTLERIN SDPTLLPNIT LGCEIRDSCW HSAVALEQS IEFIRDSLIS SEEEEGLVRC VDGSSSSFRS KKPIVGVIGP GSSSVAIQVQ NLLQLFNIPQ IAYSATSMDL S DKTLFKYF ...文字列: QSSERRVVAH MPGDIIIGAL FSVHHQPTVD KVHERKCGAV REQYGIQRVE AMLHTLERIN SDPTLLPNIT LGCEIRDSCW HSAVALEQS IEFIRDSLIS SEEEEGLVRC VDGSSSSFRS KKPIVGVIGP GSSSVAIQVQ NLLQLFNIPQ IAYSATSMDL S DKTLFKYF MRVVPSDAQQ ARAMVDIVKR YNWTYVSAVH TEGNYGESGM EAFKDMSAKE GICIAHSYKI YSNAGEQSFD KL LKKLTSH LPKARVVACF CEGMTVRGLL MAMRRLGLAG EFLLLGSDGW ADRYDVTDGY QREAVGGITI KLQSPDVKWF DDY YLKLRP ETNLRNPWFQ EFWQHRFQCR LEGFPQENSK YNKTCNSSLT LKTHHVQDSK MGFVINAIYS MAYGLHNMQM SLCP GYAGL CDAMKPIDGR KLLESLMKTA FTGVSGDTIL FDENGDSPGR YEIMNFKEMG KDYFDYINVG SWDNGELKMD DDEVW SKKS NIIRSVCSEP CEKGQIKVIR KGEVSCCWTC TPCKENEYVF DEYTCKACQL GSWPTDDLTG CDLIPVQYLR WGDPEP IAA VVFACLGLLA TLFVTVVFII YRDTPVVKSS SRELCYIILA GICLGYLCTF CLIAKPKQIY CYLQRIGIGL SPAMSYS AL VTKTNRIARI LAGSKKKICT KKPRFMSACA QLVIAFILIC IQLGIIVALF IMEPPDIMHD YPSIREVYLI CNTTNLGV V APLGYNGLLI LACTFYAFKT RNVPANFNEA KYIAFAMYTT CIIWLAFVPI YFGSNYKAIT MCFSVSLSAT VLLGCMFVP KVYIILAKPE RNVRSAFTTS TVVRMHVGDG KSSSAA UniProtKB: Metabotropic glutamate receptor 5 |
-分子 #2: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 2 / コピー数: 2 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-分子 #3: (S)-2-AMINO-3-(3,5-DIOXO-[1,2,4]OXADIAZOLIDIN-2-YL)-PROPIONIC ACID
| 分子 | 名称: (S)-2-AMINO-3-(3,5-DIOXO-[1,2,4]OXADIAZOLIDIN-2-YL)-PROPIONIC ACID タイプ: ligand / ID: 3 / コピー数: 2 / 式: QUS |
|---|---|
| 分子量 | 理論値: 189.126 Da |
| Chemical component information | 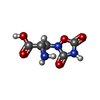 ChemComp-QUS: |
-分子 #4: VU29
| 分子 | 名称: VU29 / タイプ: ligand / ID: 4 / コピー数: 1 / 式: XRQ |
|---|---|
| 分子量 | 理論値: 384.387 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 10 sec. / 前処理 - 雰囲気: AIR | ||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: LEICA EM GP | ||||||||||
| 詳細 | Receptor is purified in detergent micelles and monodisperse. The receptor is purified with 10 uM Quisqualate and 10 uM PAM VU29 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 詳細 | Data was collected in EFTEM model with selectris and Falcon 4i |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 1 / 実像数: 9469 / 平均露光時間: 4.3 sec. / 平均電子線量: 49.62 e/Å2 詳細: Electron flux was 6.1. e/p/s. total number of frames per movie were 1395 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 倍率(補正後): 192572 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.2 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 165000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A / Chain - Source name: Other / Chain - Initial model type: experimental model / 詳細: Model from this deposition was used as template |
|---|---|
| 精密化 | 空間: REAL / プロトコル: OTHER / 温度因子: 121.7 |
| 得られたモデル |  PDB-8x0f: |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






































