+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-30229 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM Structure for the Ectodomain of the Full-length Human Insulin Receptor in Complex with 1 Insulin. | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Human Insulin Receptor / Full-length / Ectodomain / Apo / Conformation. / SIGNALING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to oxygen-containing compound / regulation of female gonad development / positive regulation of meiotic cell cycle / insulin-like growth factor II binding / positive regulation of developmental growth / male sex determination / insulin receptor complex / insulin-like growth factor I binding / positive regulation of protein-containing complex disassembly / insulin receptor activity ...cellular response to oxygen-containing compound / regulation of female gonad development / positive regulation of meiotic cell cycle / insulin-like growth factor II binding / positive regulation of developmental growth / male sex determination / insulin receptor complex / insulin-like growth factor I binding / positive regulation of protein-containing complex disassembly / insulin receptor activity / exocrine pancreas development / dendritic spine maintenance / cargo receptor activity / insulin binding / adrenal gland development / PTB domain binding / neuronal cell body membrane / negative regulation of glycogen catabolic process / positive regulation of nitric oxide mediated signal transduction / negative regulation of fatty acid metabolic process / negative regulation of feeding behavior / Signaling by Insulin receptor / IRS activation / regulation of protein secretion / Insulin processing / positive regulation of peptide hormone secretion / positive regulation of respiratory burst / negative regulation of acute inflammatory response / Regulation of gene expression in beta cells / amyloid-beta clearance / alpha-beta T cell activation / regulation of embryonic development / insulin receptor substrate binding / positive regulation of receptor internalization / positive regulation of dendritic spine maintenance / Synthesis, secretion, and deacylation of Ghrelin / epidermis development / activation of protein kinase B activity / negative regulation of respiratory burst involved in inflammatory response / negative regulation of protein secretion / protein kinase activator activity / negative regulation of gluconeogenesis / positive regulation of insulin receptor signaling pathway / positive regulation of glycogen biosynthetic process / fatty acid homeostasis / Signal attenuation / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / negative regulation of lipid catabolic process / positive regulation of lipid biosynthetic process / heart morphogenesis / negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway / regulation of protein localization to plasma membrane / transport across blood-brain barrier / phosphatidylinositol 3-kinase binding / nitric oxide-cGMP-mediated signaling / transport vesicle / COPI-mediated anterograde transport / positive regulation of nitric-oxide synthase activity / Insulin receptor recycling / negative regulation of reactive oxygen species biosynthetic process / positive regulation of brown fat cell differentiation / insulin-like growth factor receptor binding / NPAS4 regulates expression of target genes / dendrite membrane / neuron projection maintenance / endoplasmic reticulum-Golgi intermediate compartment membrane / positive regulation of mitotic nuclear division / receptor-mediated endocytosis / Insulin receptor signalling cascade / positive regulation of glycolytic process / positive regulation of cytokine production / endosome lumen / positive regulation of long-term synaptic potentiation / acute-phase response / positive regulation of protein secretion / positive regulation of D-glucose import across plasma membrane / learning / insulin receptor binding / positive regulation of cell differentiation / Regulation of insulin secretion / wound healing / positive regulation of neuron projection development / receptor protein-tyrosine kinase / hormone activity / negative regulation of protein catabolic process / regulation of synaptic plasticity / caveola / receptor internalization / cellular response to growth factor stimulus / positive regulation of protein localization to nucleus / Golgi lumen / memory / cognition / male gonad development / vasodilation / cellular response to insulin stimulus / glucose metabolic process / positive regulation of nitric oxide biosynthetic process / insulin receptor signaling pathway / late endosome 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
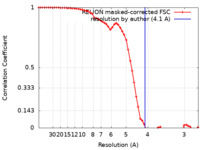
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.1 Å | |||||||||
 データ登録者 データ登録者 | Yu D / Zhang X / Sun J / Li X / Wu Z / Han X / Fan C / Ma Y / Ouyang Q / Wang T | |||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Insulin Binding Induced the Ectodomain Conformational Dynamics in the Full-length Human Insulin Receptor 著者: Yu D / Zhang X / Sun J / Li X / Wu Z / Han X / Fan C / Ma Y / Ouyang Q / Wang T | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_30229.map.gz emd_30229.map.gz | 2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-30229-v30.xml emd-30229-v30.xml emd-30229.xml emd-30229.xml | 25.7 KB 25.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_30229_fsc.xml emd_30229_fsc.xml | 5.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_30229.png emd_30229.png | 130.5 KB | ||
| Filedesc metadata |  emd-30229.cif.gz emd-30229.cif.gz | 7.3 KB | ||
| その他 |  emd_30229_half_map_1.map.gz emd_30229_half_map_1.map.gz emd_30229_half_map_2.map.gz emd_30229_half_map_2.map.gz | 11.7 MB 11.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-30229 http://ftp.pdbj.org/pub/emdb/structures/EMD-30229 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30229 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30229 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_30229_validation.pdf.gz emd_30229_validation.pdf.gz | 602.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_30229_full_validation.pdf.gz emd_30229_full_validation.pdf.gz | 601.7 KB | 表示 | |
| XML形式データ |  emd_30229_validation.xml.gz emd_30229_validation.xml.gz | 11.2 KB | 表示 | |
| CIF形式データ |  emd_30229_validation.cif.gz emd_30229_validation.cif.gz | 15.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30229 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30229 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30229 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30229 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_30229.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_30229.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.37 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #2
| ファイル | emd_30229_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
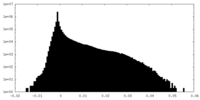
| 投影像・断面図 |
| ||||||||||||
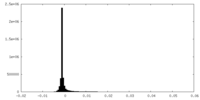
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_30229_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
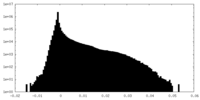
| 投影像・断面図 |
| ||||||||||||
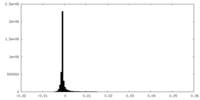
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human Insulin Receptor Complexed with 1 Insulin
| 全体 | 名称: Human Insulin Receptor Complexed with 1 Insulin |
|---|---|
| 要素 |
|
-超分子 #1: Human Insulin Receptor Complexed with 1 Insulin
| 超分子 | 名称: Human Insulin Receptor Complexed with 1 Insulin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 130 KDa |
-超分子 #2: Insulin receptor
| 超分子 | 名称: Insulin receptor / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: Insulin
| 超分子 | 名称: Insulin / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|
-分子 #1: Insulin receptor
| 分子 | 名称: Insulin receptor / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: receptor protein-tyrosine kinase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 154.114516 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: HLYPGEVCPG MDIRNNLTRL HELENCSVIE GHLQILLMFK TRPEDFRDLS FPKLIMITDY LLLFRVYGLE SLKDLFPNLT VIRGSRLFF NYALVIFEMV HLKELGLYNL MNITRGSVRI EKNNELCYLA TIDWSRILDS VEDNYIVLNK DDNEECGDIC P GTAKGKTN ...文字列: HLYPGEVCPG MDIRNNLTRL HELENCSVIE GHLQILLMFK TRPEDFRDLS FPKLIMITDY LLLFRVYGLE SLKDLFPNLT VIRGSRLFF NYALVIFEMV HLKELGLYNL MNITRGSVRI EKNNELCYLA TIDWSRILDS VEDNYIVLNK DDNEECGDIC P GTAKGKTN CPATVINGQF VERCWTHSHC QKVCPTICKS HGCTAEGLCC HSECLGNCSQ PDDPTKCVAC RNFYLDGRCV ET CPPPYYH FQDWRCVNFS FCQDLHHKCK NSRRQGCHQY VIHNNKCIPE CPSGYTMNSS NLLCTPCLGP CPKVCHLLEG EKT IDSVTS AQELRGCTVI NGSLIINIRG GNNLAAELEA NLGLIEEISG YLKIRRSYAL VSLSFFRKLR LIRGETLEIG NYSF YALDN QNLRQLWDWS KHNLTITQGK LFFHYNPKLC LSEIHKMEEV SGTKGRQERN DIALKTNGDQ ASCENELLKF SYIRT SFDK ILLRWEPYWP PDFRDLLGFM LFYKEAPYQN VTEFDGQDAC GSNSWTVVDI DPPLRSNDPK SQNHPGWLMR GLKPWT QYA IFVKTLVTFS DERRTYGAKS DIIYVQTDAT NPSVPLDPIS VSNSSSQIIL KWKPPSDPNG NITHYLVFWE RQAEDSE LF ELDYCLKGLK LPSRTWSPPF ESEDSQKHNQ SEYEDSAGEC CSCPKTDSQI LKELEESSFR KTFEDYLHNV VFVPRKTS S GTGAEDPRPS RKRRSLGDVG NVTVAVPTVA AFPNTSSTSV PTSPEEHRPF EKVVNKESLV ISGLRHFTGY RIELQACNQ DTPEERCSVA AYVSARTMPE AKADDIVGPV THEIFENNVV HLMWQEPKEP NGLIVLYEVS YRRYGDEELH LCVSRKHFAL ERGCRLRGL SPGNYSVRIR ATSLAGNGSW TEPTYFYVTD YLDVPSNIAK IIIGPLIFVF LFSVVIGSIY LFLRKRQPDG P LGPLYASS NPEYLSASDV FPCSVYVPDE WEVSREKITL LRELGQGSFG MVYEGNARDI IKGEAETRVA VKTVNESASL RE RIEFLNE ASVMKGFTCH HVVRLLGVVS KGQPTLVVME LMAHGDLKSY LRSLRPEAEN NPGRPPPTLQ EMIQMAAEIA DGM AYLNAK KFVHRDLAAR NCMVAHDFTV KIGDFGMTRD IYETDYYRKG GKGLLPVRWM APESLKDGVF TTSSDMWSFG VVLW EITSL AEQPYQGLSN EQVLKFVMDG GYLDQPDNCP ERVTDLMRMC WQFNPKMRPT FLEIVNLLKD DLHPSFPEVS FFHSE ENKA PESEELEMEF EDMENVPLDR SSHCQREEAG GRDGGSSLGF KRSYEEHIPY THMNGGKKNG RILTLPRSNP S UniProtKB: Insulin receptor |
-分子 #2: Insulin fusion
| 分子 | 名称: Insulin fusion / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 8.380529 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: FVNQHLCGSH LVEALYLVCG ERGFFYTPKT RREAEDLQGS LQPLALEGSL QKRGIVEQCC TSICSLYQLE NYCN UniProtKB: Insulin, Insulin, Insulin |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| |||||||||||||||
| グリッド | モデル: C-flat-1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 支持フィルム - Film thickness: 20 / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 4 K / 装置: FEI VITROBOT MARK III | |||||||||||||||
| 詳細 | The sample was prepared using the gradient fixation method. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | #0 - Image recording ID: 1 #0 - フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) #0 - 検出モード: SUPER-RESOLUTION / #0 - 撮影したグリッド数: 5 / #0 - 実像数: 17122 / #0 - 平均露光時間: 10.0 sec. / #0 - 平均電子線量: 50.0 e/Å2 #0 - 詳細: Images were collected in movie mode with 40 frames per 10 seconds. #1 - Image recording ID: 2 #1 - フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) #1 - 検出モード: SUPER-RESOLUTION / #1 - 平均電子線量: 50.0 e/Å2 / #2 - Image recording ID: 3 #2 - フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) #2 - 検出モード: SUPER-RESOLUTION / #2 - 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 最大 デフォーカス(補正後): 2.7 µm 最小 デフォーカス(補正後): 0.7000000000000001 µm 倍率(補正後): 43796 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.7 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 75 / 当てはまり具合の基準: Correlation coefficient | ||||||||
| 得られたモデル |  PDB-7bw7: |
-原子モデル構築 2
| 初期モデル |
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 90 / 当てはまり具合の基準: Correlation coefficient | ||||||||
| 得られたモデル |  PDB-7bw7: |
 ムービー
ムービー コントローラー
コントローラー








































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)