+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-24328 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Methanococcus maripaludis chaperonin, closed conformation 4 | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Open conformation / CHAPERONE | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-dependent protein folding chaperone / unfolded protein binding / ATP hydrolysis activity / ATP binding / metal ion binding / identical protein binding 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Methanococcus maripaludis (古細菌) Methanococcus maripaludis (古細菌) | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.1 Å | |||||||||||||||
 データ登録者 データ登録者 | Zhao Y / Schmid M | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: CryoEM reveals the stochastic nature of individual ATP binding events in a group II chaperonin. 著者: Yanyan Zhao / Michael F Schmid / Judith Frydman / Wah Chiu /  要旨: Chaperonins are homo- or hetero-oligomeric complexes that use ATP binding and hydrolysis to facilitate protein folding. ATP hydrolysis exhibits both positive and negative cooperativity. The mechanism ...Chaperonins are homo- or hetero-oligomeric complexes that use ATP binding and hydrolysis to facilitate protein folding. ATP hydrolysis exhibits both positive and negative cooperativity. The mechanism by which chaperonins coordinate ATP utilization in their multiple subunits remains unclear. Here we use cryoEM to study ATP binding in the homo-oligomeric archaeal chaperonin from Methanococcus maripaludis (MmCpn), consisting of two stacked rings composed of eight identical subunits each. Using a series of image classification steps, we obtained different structural snapshots of individual chaperonins undergoing the nucleotide binding process. We identified nucleotide-bound and free states of individual subunits in each chaperonin, allowing us to determine the ATP occupancy state of each MmCpn particle. We observe distinctive tertiary and quaternary structures reflecting variations in nucleotide occupancy and subunit conformations in each chaperonin complex. Detailed analysis of the nucleotide distribution in each MmCpn complex indicates that individual ATP binding events occur in a statistically random manner for MmCpn, both within and across the rings. Our findings illustrate the power of cryoEM to characterize a biochemical property of multi-subunit ligand binding cooperativity at the individual particle level. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_24328.map.gz emd_24328.map.gz | 2.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-24328-v30.xml emd-24328-v30.xml emd-24328.xml emd-24328.xml | 11.5 KB 11.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_24328.png emd_24328.png | 33.4 KB | ||
| Filedesc metadata |  emd-24328.cif.gz emd-24328.cif.gz | 5.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-24328 http://ftp.pdbj.org/pub/emdb/structures/EMD-24328 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24328 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24328 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_24328_validation.pdf.gz emd_24328_validation.pdf.gz | 308.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_24328_full_validation.pdf.gz emd_24328_full_validation.pdf.gz | 308.3 KB | 表示 | |
| XML形式データ |  emd_24328_validation.xml.gz emd_24328_validation.xml.gz | 6.1 KB | 表示 | |
| CIF形式データ |  emd_24328_validation.cif.gz emd_24328_validation.cif.gz | 6.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24328 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24328 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24328 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24328 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7r9kMC  7r9eC  7r9hC  7r9iC  7r9jC  7r9mC  7r9oC  7r9uC  7rakC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10770 (タイトル: Cryo-EM reveals the stochastic nature of individual ATP binding events in a group II chaperonin EMPIAR-10770 (タイトル: Cryo-EM reveals the stochastic nature of individual ATP binding events in a group II chaperoninData size: 48.4 Data #1: aligned particle image [picked particles - single frame - processed]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_24328.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_24328.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
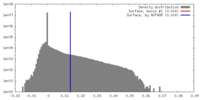
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : MmCpn
| 全体 | 名称: MmCpn |
|---|---|
| 要素 |
|
-超分子 #1: MmCpn
| 超分子 | 名称: MmCpn / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Methanococcus maripaludis (古細菌) Methanococcus maripaludis (古細菌) |
| 分子量 | 理論値: 1 MDa |
-分子 #1: Chaperonin
| 分子 | 名称: Chaperonin / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Methanococcus maripaludis (古細菌) Methanococcus maripaludis (古細菌) |
| 分子量 | 理論値: 54.372539 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: RDAQRMNILA GRIIAETVRS TLGPKGMDKM LVDDLGDVVV TNDGVTILRE MSVEHPAAKM LIEVAKTQEK EVGDGTTTAV VVAGELLRK AEELLDQNVH PTIVVKGYQA AAQKAQELLK TIACEVGAQD KEILTKIAMT SITGKGAEKA KEKLAEIIVE A VSAVVDDE ...文字列: RDAQRMNILA GRIIAETVRS TLGPKGMDKM LVDDLGDVVV TNDGVTILRE MSVEHPAAKM LIEVAKTQEK EVGDGTTTAV VVAGELLRK AEELLDQNVH PTIVVKGYQA AAQKAQELLK TIACEVGAQD KEILTKIAMT SITGKGAEKA KEKLAEIIVE A VSAVVDDE GKVDKDLIKI EKKSGASIDD TELIKGVLVD KERVSAQMPK KVTDAKIALL NCAIEIKETE TDAEIRITDP AK LMEFIEQ EEKMLKDMVA EIKASGANVL FCQKGIDDLA QHYLAKEGIV AARRVKKSDM EKLAKATGAN VITNIKDLSA QDL GDAGLV EERKISGDSM IFVEECKHPK AVTMLIRGTT EHVIEEVARA VDDAVGVVGC TIEDGRIVSG GGSTEVELSM KLRE YAEGI SGREQLAVRA FADALEVIPR TLAENAGLDA IEILVKVRAA HASNGNKCAG LNVFTGAVED MCENGVVEPL RVKTQ AIQS AAESTEMLLR IDDVIAAEKL R UniProtKB: Thermosome subunit |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 238000 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
-原子モデル構築 1
| 精密化 | プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-7r9k: |
 ムービー
ムービー コントローラー
コントローラー























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)