+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11014 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
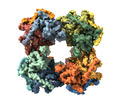
| タイトル | Cryo-EM map of human dihydrolipoamide succinyltransferase catalytic domain (DLST) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
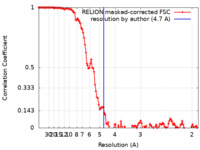
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.7 Å | |||||||||
 データ登録者 データ登録者 | Bailey HJ / Bezerra GA / Foster W / McCorvie TJ / Saez LD / Yue WW | |||||||||
 引用 引用 |  ジャーナル: IUCrJ / 年: 2020 ジャーナル: IUCrJ / 年: 2020タイトル: Crystal structure and interaction studies of human DHTKD1 provide insight into a mitochondrial megacomplex in lysine catabolism. 著者: Gustavo A Bezerra / William R Foster / Henry J Bailey / Kevin G Hicks / Sven W Sauer / Bianca Dimitrov / Thomas J McCorvie / Jürgen G Okun / Jared Rutter / Stefan Kölker / Wyatt W Yue /    要旨: DHTKD1 is a lesser-studied E1 enzyme among the family of 2-oxoacid de-hydrogenases. In complex with E2 (di-hydro-lipo-amide succinyltransferase, DLST) and E3 (dihydrolipo-amide de-hydrogenase, DLD) ...DHTKD1 is a lesser-studied E1 enzyme among the family of 2-oxoacid de-hydrogenases. In complex with E2 (di-hydro-lipo-amide succinyltransferase, DLST) and E3 (dihydrolipo-amide de-hydrogenase, DLD) components, DHTKD1 is involved in lysine and tryptophan catabolism by catalysing the oxidative de-carboxyl-ation of 2-oxoadipate (2OA) in mitochondria. Here, the 1.9 Å resolution crystal structure of human DHTKD1 is solved in complex with the thi-amine diphosphate co-factor. The structure reveals how the DHTKD1 active site is modelled upon the well characterized homologue 2-oxoglutarate (2OG) de-hydrogenase but engineered specifically to accommodate its preference for the longer substrate of 2OA over 2OG. A 4.7 Å resolution reconstruction of the human DLST catalytic core is also generated by single-particle electron microscopy, revealing a 24-mer cubic scaffold for assembling DHTKD1 and DLD protomers into a megacomplex. It is further demonstrated that missense DHTKD1 variants causing the inborn error of 2-amino-adipic and 2-oxoadipic aciduria impact on the complex formation, either directly by disrupting the interaction with DLST, or indirectly through destabilizing the DHTKD1 protein. This study provides the starting framework for developing DHTKD1 modulators to probe the intricate mitochondrial energy metabolism. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11014.map.gz emd_11014.map.gz | 13.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11014-v30.xml emd-11014-v30.xml emd-11014.xml emd-11014.xml | 11.7 KB 11.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_11014_fsc.xml emd_11014_fsc.xml | 12.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_11014.png emd_11014.png | 185.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11014 http://ftp.pdbj.org/pub/emdb/structures/EMD-11014 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11014 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11014 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11014_validation.pdf.gz emd_11014_validation.pdf.gz | 250.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11014_full_validation.pdf.gz emd_11014_full_validation.pdf.gz | 249.4 KB | 表示 | |
| XML形式データ |  emd_11014_validation.xml.gz emd_11014_validation.xml.gz | 12.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11014 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11014 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11014 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11014 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11014.map.gz / 形式: CCP4 / 大きさ: 155.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11014.map.gz / 形式: CCP4 / 大きさ: 155.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.96 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
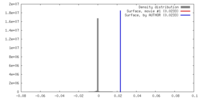
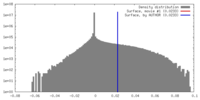
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : human dihydrolipoamide succinyltransferase (DLST)
| 全体 | 名称: human dihydrolipoamide succinyltransferase (DLST) |
|---|---|
| 要素 |
|
-超分子 #1: human dihydrolipoamide succinyltransferase (DLST)
| 超分子 | 名称: human dihydrolipoamide succinyltransferase (DLST) / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 1.059 MDa |
-分子 #1: human dihydrolipoamide succinyltransferase catalytic domain (DLST)
| 分子 | 名称: human dihydrolipoamide succinyltransferase catalytic domain (DLST) タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGHHHHHHSS GVDLGTENLY FQSMDDLVTV KTPAFAESVT EGDVRWEKAV GDTVAEDEVV CEIETDKTSV QVPSPANGVI EALLVPDGGK VEGGTPLFTL RKTGAAPAKA KPAEAPAAAA PKAEPTAAAV PPPAAPIPTQ MPPVPSPSQP PSGKPVSAVK PTVAPPLAEP ...文字列: MGHHHHHHSS GVDLGTENLY FQSMDDLVTV KTPAFAESVT EGDVRWEKAV GDTVAEDEVV CEIETDKTSV QVPSPANGVI EALLVPDGGK VEGGTPLFTL RKTGAAPAKA KPAEAPAAAA PKAEPTAAAV PPPAAPIPTQ MPPVPSPSQP PSGKPVSAVK PTVAPPLAEP GAGKGLRSEH REKMNRMRQR IAQRLKEAQN TCAMLTTFNE IDMSNIQEMR ARHKEAFLKK HNLKLGFMSA FVKASAFALQ EQPVVNAVID DTTKEVVYRD YIDISVAVAT PRGLVVPVIR NVEAMNFADI ERTITELGEK ARKNELAIED MDGGTFTISN GGVFGSLFGT PIINPPQSAI LGMHGIFDRP VAIGGKVEVR PMMYVALTYD HRLIDGREAV TFLRKIKAAV EDPRVLLLDL |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: OTHER / 撮影したグリッド数: 1 / 実像数: 619 / 平均露光時間: 1.0 sec. / 平均電子線量: 32.52 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER / 倍率(公称値): 150000 |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)