+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-0928 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
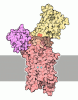
| タイトル | mutation transporter state1-2 | |||||||||
 マップデータ マップデータ | sharpened map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | calcium / METAL TRANSPORT | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報longitudinal sarcoplasmic reticulum / ER-nucleus signaling pathway / positive regulation of endoplasmic reticulum calcium ion concentration / P-type calcium transporter activity involved in regulation of cardiac muscle cell membrane potential / calcium ion transport from cytosol to endoplasmic reticulum / regulation of calcium ion-dependent exocytosis of neurotransmitter / calcium ion-transporting ATPase complex / T-tubule organization / regulation of cardiac muscle cell action potential involved in regulation of contraction / regulation of cardiac muscle cell membrane potential ...longitudinal sarcoplasmic reticulum / ER-nucleus signaling pathway / positive regulation of endoplasmic reticulum calcium ion concentration / P-type calcium transporter activity involved in regulation of cardiac muscle cell membrane potential / calcium ion transport from cytosol to endoplasmic reticulum / regulation of calcium ion-dependent exocytosis of neurotransmitter / calcium ion-transporting ATPase complex / T-tubule organization / regulation of cardiac muscle cell action potential involved in regulation of contraction / regulation of cardiac muscle cell membrane potential / sarcoplasmic reticulum calcium ion transport / platelet dense tubular network membrane / calcium ion import into sarcoplasmic reticulum / Pre-NOTCH Processing in Golgi / negative regulation of heart contraction / ribbon synapse / P-type Ca2+ transporter / P-type calcium transporter activity / regulation of the force of heart contraction / transition between fast and slow fiber / endoplasmic reticulum calcium ion homeostasis / cardiac muscle hypertrophy in response to stress / S100 protein binding / relaxation of cardiac muscle / regulation of cardiac muscle contraction by calcium ion signaling / Reduction of cytosolic Ca++ levels / organelle localization by membrane tethering / mitochondrion-endoplasmic reticulum membrane tethering / autophagosome membrane docking / lncRNA binding / Ion transport by P-type ATPases / autophagosome assembly / regulation of cardiac conduction / epidermis development / positive regulation of heart rate / positive regulation of cardiac muscle cell apoptotic process / Ion homeostasis / sarcoplasmic reticulum membrane / response to endoplasmic reticulum stress / sarcoplasmic reticulum / calcium channel regulator activity / neuron cellular homeostasis / calcium ion transmembrane transport / intracellular calcium ion homeostasis / cellular response to oxidative stress / monoatomic ion transmembrane transport / transmembrane transporter binding / cell adhesion / calcium ion binding / endoplasmic reticulum membrane / enzyme binding / endoplasmic reticulum / ATP hydrolysis activity / ATP binding / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Zhang Y / Tsutsumi A | |||||||||
| 資金援助 |  日本, 1件 日本, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2020 ジャーナル: Sci Adv / 年: 2020タイトル: Cryo-EM structures of SERCA2b reveal the mechanism of regulation by the luminal extension tail. 著者: Yuxia Zhang / Michio Inoue / Akihisa Tsutsumi / Satoshi Watanabe / Tomohiro Nishizawa / Kazuhiro Nagata / Masahide Kikkawa / Kenji Inaba /  要旨: Sarco/endoplasmic reticulum Ca ATPase (SERCA) pumps Ca from the cytosol into the ER and maintains the cellular calcium homeostasis. Herein, we present cryo-electron microscopy (cryo-EM) structures of ...Sarco/endoplasmic reticulum Ca ATPase (SERCA) pumps Ca from the cytosol into the ER and maintains the cellular calcium homeostasis. Herein, we present cryo-electron microscopy (cryo-EM) structures of human SERCA2b in E1∙2Ca-adenylyl methylenediphosphonate (AMPPCP) and E2-BeF states at 2.9- and 2.8-Å resolutions, respectively. The structures revealed that the luminal extension tail (LE) characteristic of SERCA2b runs parallel to the lipid-water boundary near the luminal ends of transmembrane (TM) helices TM10 and TM7 and approaches the luminal loop flanked by TM7 and TM8. While the LE served to stabilize the cytosolic and TM domain arrangement of SERCA2b, deletion of the LE rendered the overall conformation resemble that of SERCA1a and SERCA2a and allowed multiple conformations. Thus, the LE appears to play a critical role in conformational regulation in SERCA2b, which likely explains the different kinetic properties of SERCA2b from those of other isoforms lacking the LE. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0928.map.gz emd_0928.map.gz | 2.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0928-v30.xml emd-0928-v30.xml emd-0928.xml emd-0928.xml | 21.9 KB 21.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0928_fsc.xml emd_0928_fsc.xml | 6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0928.png emd_0928.png | 61.2 KB | ||
| マスクデータ |  emd_0928_msk_1.map emd_0928_msk_1.map | 18.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-0928.cif.gz emd-0928.cif.gz | 6.9 KB | ||
| その他 |  emd_0928_additional.map.gz emd_0928_additional.map.gz emd_0928_half_map_1.map.gz emd_0928_half_map_1.map.gz emd_0928_half_map_2.map.gz emd_0928_half_map_2.map.gz | 13.7 MB 13.8 MB 13.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0928 http://ftp.pdbj.org/pub/emdb/structures/EMD-0928 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0928 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0928 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_0928_validation.pdf.gz emd_0928_validation.pdf.gz | 717.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_0928_full_validation.pdf.gz emd_0928_full_validation.pdf.gz | 717.4 KB | 表示 | |
| XML形式データ |  emd_0928_validation.xml.gz emd_0928_validation.xml.gz | 11.5 KB | 表示 | |
| CIF形式データ |  emd_0928_validation.cif.gz emd_0928_validation.cif.gz | 16.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0928 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0928 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0928 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0928 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6ln9MC  0912C  0915C  0924C  0925C  0926C  0927C  6lleC  6llyC  6ln5C  6ln6C  6ln7C  6ln8C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0928.map.gz / 形式: CCP4 / 大きさ: 18.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0928.map.gz / 形式: CCP4 / 大きさ: 18.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | sharpened map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.245 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
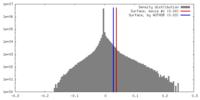
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_0928_msk_1.map emd_0928_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
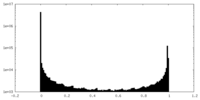
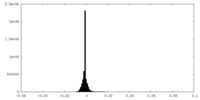
| 密度ヒストグラム |
-追加マップ: non-sharpened map
| ファイル | emd_0928_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | non-sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
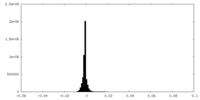
| 密度ヒストグラム |
-ハーフマップ: half2 map
| ファイル | emd_0928_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half2 map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
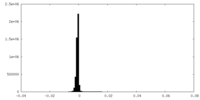
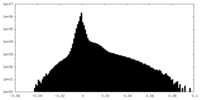
| 密度ヒストグラム |
-ハーフマップ: half1 map
| ファイル | emd_0928_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half1 map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
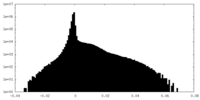
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : SERCA2b MUTATION with BEF -2
| 全体 | 名称: SERCA2b MUTATION with BEF -2 |
|---|---|
| 要素 |
|
-超分子 #1: SERCA2b MUTATION with BEF -2
| 超分子 | 名称: SERCA2b MUTATION with BEF -2 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 110 kDa/nm |
-分子 #1: Sarcoplasmic/endoplasmic reticulum calcium ATPase 2
| 分子 | 名称: Sarcoplasmic/endoplasmic reticulum calcium ATPase 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: P-type Ca2+ transporter |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 116.432453 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGGVAMPGAE DDVVRENLYF QGKDGLAAME NAHTKTVEEV LGHFGVNEST GLSLEQVKKL KERWGSNELP AEEGKTLLEL VIEQFEDLL VRILLLAACI SFVLAWFEEG EETITAFVEP FVILLILVAN AIVGVWQERN AENAIEALKE YEPEMGKVYR Q DRKSVQRI ...文字列: MGGVAMPGAE DDVVRENLYF QGKDGLAAME NAHTKTVEEV LGHFGVNEST GLSLEQVKKL KERWGSNELP AEEGKTLLEL VIEQFEDLL VRILLLAACI SFVLAWFEEG EETITAFVEP FVILLILVAN AIVGVWQERN AENAIEALKE YEPEMGKVYR Q DRKSVQRI KAKDIVPGDI VEIAVGDKVP ADIRLTSIKS TTLRVDQSIL TGESVSVIKH TDPVPDPRAV NQDKKNMLFS GT NIAAGKA MGVVVATGVN TEIGKIRDEM VATEQERTPL QQKLDEFGEQ LSKVISLICI AVWIINIGHF NDPVHGGSWI RGA IYYFKI AVALAVAAIP EGLPAVITTC LALGTRRMAK KNAIVRSLPS VETLGCTSVI CSDKTGTLTT NQMSVCRMFI LDRV EGDTC SLNEFTITGS TYAPIGEVHK DDKPVNCHQY DGLVELATIC ALCNDSALDY NEAKGVYEKV GEATETALTC LVEKM NVFD TELKGLSKIE RANACNSVIK QLMKKEFTLE FSRDRKSMSV YCTPNKPSRT SMSKMFVKGA PEGVIDRCTH IRVGST KVP MTSGVKQKIM SVIREWGSGS DTLRCLALAT HDNPLRREEM HLEDSANFIK YETNLTFVGC VGMLDPPRIE VASSVKL CR QAGIRVIMIT GDNKGTAVAI CRRIGIFGQD EDVTSKAFTG REFDELNPSA QRDACLNARC FARVEPSHKS KIVEFLQS F DEITAMTGDG VNDAPALKKA EIGIAMGSGT AVAKTASEMV LADDNFSTIV AAVEEGRAIY NNMKQFIRYL ISSNVGEVV CIFLTAALGF PEALIPVQLL WVNLVTDGLP ATALGFNPPD LDIMNKPPRN PKEPLISGWL FFRYLAIGCY VGAATVGAAA WWFIAADGG PRVSFYQLSH FLQCKEDNPD FEGVDCAIFE SPYPMTMALS VLVTIEMCNA LNSLSENQSL LRMPPWENIW L VGSICLSM SLHFLILYVE PLPLIFQITP LNVTQWLMVL KISLPVILMD ETLKFVARNY LEPGKECVQP ATKSCSFSAC TD GISWPFV LLIMPLVIWV YS UniProtKB: Sarcoplasmic/endoplasmic reticulum calcium ATPase 2 |
-分子 #2: BERYLLIUM TRIFLUORIDE ION
| 分子 | 名称: BERYLLIUM TRIFLUORIDE ION / タイプ: ligand / ID: 2 / コピー数: 1 / 式: BEF |
|---|---|
| 分子量 | 理論値: 66.007 Da |
| Chemical component information | 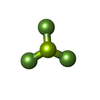 ChemComp-BEF: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)