登録情報 データベース : PDB / ID : 7oceタイトル Resting state GluA1/A2 AMPA receptor in complex with TARP gamma 8 and CNIH2 (LBD-TMD) (Glutamate receptor ...) x 2 Protein cornichon homolog 2 Voltage-dependent calcium channel gamma-8 subunit キーワード / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Rattus norvegicus (ドブネズミ)手法 / / / 解像度 : 3.1 Å データ登録者 Zhang, D. / Watson, J.F. / Matthews, P.M. / Cais, O. / Greger, I.H. 資金援助 2件 組織 認可番号 国 Medical Research Council (MRC, United Kingdom) MC_U105174197 Biotechnology and Biological Sciences Research Council (BBSRC) BB/N002113/1
ジャーナル : Nature / 年 : 2021タイトル : Gating and modulation of a hetero-octameric AMPA glutamate receptor.著者 : Danyang Zhang / Jake F Watson / Peter M Matthews / Ondrej Cais / Ingo H Greger / 要旨 : AMPA receptors (AMPARs) mediate the majority of excitatory transmission in the brain and enable the synaptic plasticity that underlies learning. A diverse array of AMPAR signalling complexes are ... AMPA receptors (AMPARs) mediate the majority of excitatory transmission in the brain and enable the synaptic plasticity that underlies learning. A diverse array of AMPAR signalling complexes are established by receptor auxiliary subunits, which associate with the AMPAR in various combinations to modulate trafficking, gating and synaptic strength. However, their mechanisms of action are poorly understood. Here we determine cryo-electron microscopy structures of the heteromeric GluA1-GluA2 receptor assembled with both TARP-γ8 and CNIH2, the predominant AMPAR complex in the forebrain, in both resting and active states. Two TARP-γ8 and two CNIH2 subunits insert at distinct sites beneath the ligand-binding domains of the receptor, with site-specific lipids shaping each interaction and affecting the gating regulation of the AMPARs. Activation of the receptor leads to asymmetry between GluA1 and GluA2 along the ion conduction path and an outward expansion of the channel triggers counter-rotations of both auxiliary subunit pairs, promoting the active-state conformation. In addition, both TARP-γ8 and CNIH2 pivot towards the pore exit upon activation, extending their reach for cytoplasmic receptor elements. CNIH2 achieves this through its uniquely extended M2 helix, which has transformed this endoplasmic reticulum-export factor into a powerful AMPAR modulator that is capable of providing hippocampal pyramidal neurons with their integrative synaptic properties. 履歴 登録 2021年4月26日 登録サイト / 処理サイト 改定 1.0 2021年6月9日 Provider / タイプ 改定 1.1 2021年6月16日 Group / カテゴリ / Item / _citation.title改定 1.2 2021年6月30日 Group / カテゴリ Item / _citation.page_first / _citation.page_last改定 1.3 2024年10月16日 Group Data collection / Database references ... Data collection / Database references / Refinement description / Structure summary カテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / em_3d_fitting_list / em_admin / pdbx_entry_details / pdbx_initial_refinement_model / pdbx_modification_feature Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _em_3d_fitting_list.accession_code / _em_3d_fitting_list.initial_refinement_model_id / _em_3d_fitting_list.source_name / _em_3d_fitting_list.type / _em_admin.last_update / _pdbx_entry_details.has_protein_modification
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 引用
引用 ジャーナル: Nature / 年: 2021
ジャーナル: Nature / 年: 2021

 構造の表示
構造の表示 ムービービューア
ムービービューア Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7oce.cif.gz
7oce.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7oce.ent.gz
pdb7oce.ent.gz PDB形式
PDB形式 7oce.json.gz
7oce.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 7oce_validation.pdf.gz
7oce_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 7oce_full_validation.pdf.gz
7oce_full_validation.pdf.gz 7oce_validation.xml.gz
7oce_validation.xml.gz 7oce_validation.cif.gz
7oce_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/oc/7oce
https://data.pdbj.org/pub/pdb/validation_reports/oc/7oce ftp://data.pdbj.org/pub/pdb/validation_reports/oc/7oce
ftp://data.pdbj.org/pub/pdb/validation_reports/oc/7oce リンク
リンク 集合体
集合体
 要素
要素
 Homo sapiens (ヒト) / 参照: UniProt: P19490
Homo sapiens (ヒト) / 参照: UniProt: P19490
 Homo sapiens (ヒト) / 参照: UniProt: P19491
Homo sapiens (ヒト) / 参照: UniProt: P19491
 Homo sapiens (ヒト) / 参照: UniProt: Q5BJU5
Homo sapiens (ヒト) / 参照: UniProt: Q5BJU5
 Homo sapiens (ヒト) / 参照: UniProt: Q8VHW5
Homo sapiens (ヒト) / 参照: UniProt: Q8VHW5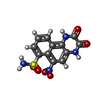



 試料調製
試料調製
 Homo sapiens (ヒト)
Homo sapiens (ヒト) 電子顕微鏡撮影
電子顕微鏡撮影
 FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM
FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM 解析
解析 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj
















