+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6ilk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 要素 要素 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 キーワード キーワード | VIRUS / Echovirus 6 / CD55 / Cryo-EM / virus-receptor complex | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of lipopolysaccharide-mediated signaling pathway / negative regulation of complement activation / regulation of complement-dependent cytotoxicity / regulation of complement activation / respiratory burst / positive regulation of CD4-positive, alpha-beta T cell activation / positive regulation of CD4-positive, alpha-beta T cell proliferation / Class B/2 (Secretin family receptors) / ficolin-1-rich granule membrane / complement activation, classical pathway ...regulation of lipopolysaccharide-mediated signaling pathway / negative regulation of complement activation / regulation of complement-dependent cytotoxicity / regulation of complement activation / respiratory burst / positive regulation of CD4-positive, alpha-beta T cell activation / positive regulation of CD4-positive, alpha-beta T cell proliferation / Class B/2 (Secretin family receptors) / ficolin-1-rich granule membrane / complement activation, classical pathway / transport vesicle / side of membrane / COPI-mediated anterograde transport / endoplasmic reticulum-Golgi intermediate compartment membrane / secretory granule membrane / Regulation of Complement cascade / positive regulation of T cell cytokine production / virus receptor activity / positive regulation of cytosolic calcium ion concentration / membrane raft / Golgi membrane / innate immune response / lipid binding / Neutrophil degranulation / cell surface / extracellular exosome / extracellular region / plasma membrane 類似検索 - 分子機能 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Gao, G.F. / Liu, S. / Zhao, X. / Peng, R. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2019 ジャーナル: Cell / 年: 2019タイトル: Human Neonatal Fc Receptor Is the Cellular Uncoating Receptor for Enterovirus B. 著者: Xin Zhao / Guigen Zhang / Sheng Liu / Xiangpeng Chen / Ruchao Peng / Lianpan Dai / Xiao Qu / Shihua Li / Hao Song / Zhengrong Gao / Pengfei Yuan / Zhiheng Liu / Changyao Li / Zifang Shang / ...著者: Xin Zhao / Guigen Zhang / Sheng Liu / Xiangpeng Chen / Ruchao Peng / Lianpan Dai / Xiao Qu / Shihua Li / Hao Song / Zhengrong Gao / Pengfei Yuan / Zhiheng Liu / Changyao Li / Zifang Shang / Yan Li / Meifan Zhang / Jianxun Qi / Han Wang / Ning Du / Yan Wu / Yuhai Bi / Shan Gao / Yi Shi / Jinghua Yan / Yong Zhang / Zhengde Xie / Wensheng Wei / George F Gao /  要旨: Enterovirus B (EV-B), a major proportion of the genus Enterovirus in the family Picornaviridae, is the causative agent of severe human infectious diseases. Although cellular receptors for ...Enterovirus B (EV-B), a major proportion of the genus Enterovirus in the family Picornaviridae, is the causative agent of severe human infectious diseases. Although cellular receptors for coxsackievirus B in EV-B have been identified, receptors mediating virus entry, especially the uncoating process of echovirus and other EV-B remain obscure. Here, we found that human neonatal Fc receptor (FcRn) is the uncoating receptor for major EV-B. FcRn binds to the virus particles in the "canyon" through its FCGRT subunit. By obtaining multiple cryo-electron microscopy structures at different stages of virus entry at atomic or near-atomic resolution, we deciphered the underlying mechanisms of enterovirus attachment and uncoating. These structures revealed that different from the attachment receptor CD55, binding of FcRn to the virions induces efficient release of "pocket factor" under acidic conditions and initiates the conformational changes in viral particle, providing a structural basis for understanding the mechanisms of enterovirus entry. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6ilk.cif.gz 6ilk.cif.gz | 198.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6ilk.ent.gz pdb6ilk.ent.gz | 154 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6ilk.json.gz 6ilk.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6ilk_validation.pdf.gz 6ilk_validation.pdf.gz | 980.9 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6ilk_full_validation.pdf.gz 6ilk_full_validation.pdf.gz | 994.5 KB | 表示 | |
| XML形式データ |  6ilk_validation.xml.gz 6ilk_validation.xml.gz | 40.7 KB | 表示 | |
| CIF形式データ |  6ilk_validation.cif.gz 6ilk_validation.cif.gz | 61.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/il/6ilk https://data.pdbj.org/pub/pdb/validation_reports/il/6ilk ftp://data.pdbj.org/pub/pdb/validation_reports/il/6ilk ftp://data.pdbj.org/pub/pdb/validation_reports/il/6ilk | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9685MC  9684C  9686C  9687C  9688C  9689C  9690C  6iljC  6illC  6ilmC  6ilnC  6iloC  6ilpC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | x 60
|
| 2 |
|
| 3 | x 5
|
| 4 | x 6
|
| 5 | 
|
| 対称性 | 点対称性: (シェーンフリース記号: I (正20面体型対称)) |
- 要素
要素
-Capsid protein ... , 4種, 4分子 ABCD
| #1: タンパク質 | 分子量: 31707.332 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
|---|---|
| #2: タンパク質 | 分子量: 28064.520 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| #3: タンパク質 | 分子量: 26378.936 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| #4: タンパク質 | 分子量: 7338.014 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
-タンパク質 / 非ポリマー , 2種, 2分子 E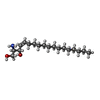

| #5: タンパク質 | 分子量: 21307.959 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CD55 / Cell (発現宿主): 293T / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CD55 / Cell (発現宿主): 293T / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P08174 Homo sapiens (ヒト) / 参照: UniProt: P08174 |
|---|---|
| #6: 化合物 | ChemComp-SPH / |
-詳細
| Has protein modification | Y |
|---|---|
| 配列の詳細 | THE SEQUENCE OF THIS PROTEIN WAS NOT AVAILABLE AT THE UNIPROT KNOWLEDGEBASE DATABASE (UNIPROTKB) AT ...THE SEQUENCE OF THIS PROTEIN WAS NOT AVAILABLE AT THE UNIPROT KNOWLEDGEB |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 タイプ: COMPLEX / Entity ID: #1-#5 / 由来: MULTIPLE SOURCES |
|---|---|
| 分子量 | 単位: MEGADALTONS / 実験値: NO |
| 由来(天然) | 生物種:  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: SPECIES / タイプ: VIRION |
| 天然宿主 | 生物種: Homo sapiens |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 40 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.11.1_2575: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア | 名称: PHENIX / カテゴリ: モデル精密化 | ||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 28528 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj






