+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12104 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the dihydrolipoyl transacetylase cubic core of the E. coli pyruvate dehydrogenase complex including lipoyl domains | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報pyruvate catabolic process / dihydrolipoyllysine-residue acetyltransferase / dihydrolipoyllysine-residue acetyltransferase activity / acetyl-CoA biosynthetic process from pyruvate / lipoic acid binding / pyruvate dehydrogenase complex / pyruvate metabolic process / acetyltransferase activity / glycolytic process / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.16 Å | |||||||||
 データ登録者 データ登録者 | Skerlova J / Stenmark P | |||||||||
| 資金援助 |  スウェーデン, European Union, 2件 スウェーデン, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Structure of the native pyruvate dehydrogenase complex reveals the mechanism of substrate insertion. 著者: Jana Škerlová / Jens Berndtsson / Hendrik Nolte / Martin Ott / Pål Stenmark /   要旨: The pyruvate dehydrogenase complex (PDHc) links glycolysis to the citric acid cycle by converting pyruvate into acetyl-coenzyme A. PDHc encompasses three enzymatically active subunits, namely ...The pyruvate dehydrogenase complex (PDHc) links glycolysis to the citric acid cycle by converting pyruvate into acetyl-coenzyme A. PDHc encompasses three enzymatically active subunits, namely pyruvate dehydrogenase, dihydrolipoyl transacetylase, and dihydrolipoyl dehydrogenase. Dihydrolipoyl transacetylase is a multidomain protein comprising a varying number of lipoyl domains, a peripheral subunit-binding domain, and a catalytic domain. It forms the structural core of the complex, provides binding sites for the other enzymes, and shuffles reaction intermediates between the active sites through covalently bound lipoyl domains. The molecular mechanism by which this shuttling occurs has remained elusive. Here, we report a cryo-EM reconstruction of the native E. coli dihydrolipoyl transacetylase core in a resting state. This structure provides molecular details of the assembly of the core and reveals how the lipoyl domains interact with the core at the active site. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12104.map.gz emd_12104.map.gz | 97.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12104-v30.xml emd-12104-v30.xml emd-12104.xml emd-12104.xml | 24.1 KB 24.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12104_fsc.xml emd_12104_fsc.xml | 10.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12104.png emd_12104.png | 90.7 KB | ||
| マスクデータ |  emd_12104_msk_1.map emd_12104_msk_1.map | 103 MB |  マスクマップ マスクマップ | |
| その他 |  emd_12104_half_map_1.map.gz emd_12104_half_map_1.map.gz emd_12104_half_map_2.map.gz emd_12104_half_map_2.map.gz | 95.5 MB 95.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12104 http://ftp.pdbj.org/pub/emdb/structures/EMD-12104 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12104 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12104 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12104_validation.pdf.gz emd_12104_validation.pdf.gz | 570.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12104_full_validation.pdf.gz emd_12104_full_validation.pdf.gz | 569.7 KB | 表示 | |
| XML形式データ |  emd_12104_validation.xml.gz emd_12104_validation.xml.gz | 18.2 KB | 表示 | |
| CIF形式データ |  emd_12104_validation.cif.gz emd_12104_validation.cif.gz | 23.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12104 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12104 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12104 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12104 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12104.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12104.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_12104_msk_1.map emd_12104_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
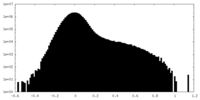
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_12104_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
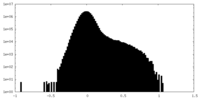
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_12104_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : dihydrolipoyl transacetylase cubic core of the pyruvate dehydroge...
| 全体 | 名称: dihydrolipoyl transacetylase cubic core of the pyruvate dehydrogenase complex |
|---|---|
| 要素 |
|
-超分子 #1: dihydrolipoyl transacetylase cubic core of the pyruvate dehydroge...
| 超分子 | 名称: dihydrolipoyl transacetylase cubic core of the pyruvate dehydrogenase complex タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Dihydrolipoyllysine-residue acetyltransferase component of pyruva...
| 分子 | 名称: Dihydrolipoyllysine-residue acetyltransferase component of pyruvate dehydrogenase complex タイプ: protein_or_peptide / ID: 1 / 詳細: Lysine 248 covalently modified by dihydrolipoate / コピー数: 24 / 光学異性体: LEVO / EC番号: dihydrolipoyllysine-residue acetyltransferase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 66.363203 KDa |
| 配列 | 文字列: MAIEIKVPDI GADEVEITEI LVKVGDKVEA EQSLITVEGD KASMEVPSPQ AGIVKEIKVS VGDKTQTGAL IMIFDSADGA ADAAPAQAE EKKEAAPAAA PAAAAAKDVN VPDIGSDEVE VTEILVKVGD KVEAEQSLIT VEGDKASMEV PAPFAGTVKE I KVNVGDKV ...文字列: MAIEIKVPDI GADEVEITEI LVKVGDKVEA EQSLITVEGD KASMEVPSPQ AGIVKEIKVS VGDKTQTGAL IMIFDSADGA ADAAPAQAE EKKEAAPAAA PAAAAAKDVN VPDIGSDEVE VTEILVKVGD KVEAEQSLIT VEGDKASMEV PAPFAGTVKE I KVNVGDKV STGSLIMVFE VAGEAGAAAP AAKQEAAPAA APAPAAGVKE VNVPDIGGDE VEVTEVMVKV GDKVAAEQSL IT VEGD(LA2)AS MEVPAPFAGV VKELKVNVGD KVKTGSLIMI FEVEGAAPAA APAKQEAAAP APAAKAEAPA AAPAAKAEG KSEFAENDAY VHATPLIRRL AREFGVNLAK VKGTGRKGRI LREDVQAYVK EAIKRAEAAP AATGGGIPGM LPWPKVDFSK FGEIEEVEL GRIQKISGAN LSRNWVMIPH VTHFDKTDIT ELEAFRKQQN EEAAKRKLDV KITPVVFIMK AVAAALEQMP R FNSSLSED GQRLTLKKYI NIGVAVDTPN GLVVPVFKDV NKKGIIELSR ELMTISKKAR DGKLTAGEMQ GGCFTISSIG GL GTTHFAP IVNAPEVAIL GVSKSAMEPV WNGKEFVPRL MLPISLSFDH RVIDGADGAR FITIINNTLS DIRRLVM |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製 #1
試料調製 #1
| Preparation ID | 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 濃度 | 0.6 mg/mL | |||||||||
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - Film type ID: 1 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 12.0 nm / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: 3 microliters of sample, blot force 0, 15 second wait time, 3 second blot time. |
- 試料調製 #2
試料調製 #2
| Preparation ID | 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 濃度 | 1.4 mg/mL | |||||||||
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - Film type ID: 1 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 12.0 nm / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: 3 microliters of sample, blot force 0, 15 second wait time, 3 second blot time. |
- 試料調製 #3
試料調製 #3
| Preparation ID | 3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 濃度 | 0.7 mg/mL | |||||||||
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - Film type ID: 1 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 12.0 nm / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: 3 microliters of sample, blot force 0, 15 second wait time, 3 second blot time. |
- 電子顕微鏡法 #1
電子顕微鏡法 #1
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | FEI TITAN KRIOS |
| 撮影 | Image recording ID: 1 フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 3708 / 平均電子線量: 30.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 電子顕微鏡法 #1~
電子顕微鏡法 #1~
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | FEI TITAN KRIOS |
| 撮影 | Image recording ID: 2 フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 3558 / 平均電子線量: 28.11 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 電子顕微鏡法 #1~~
電子顕微鏡法 #1~~
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | FEI TITAN KRIOS |
| 撮影 | Image recording ID: 3 フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 12867 / 平均電子線量: 28.11 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z
Z Y
Y X
X