+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5iid | ||||||
|---|---|---|---|---|---|---|---|
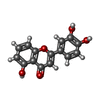
| タイトル | Crystal Structure of the fifth bromodomain of human polybromo (PB1) in complex with 2-(3,4-dihydroxyphenyl)-5-hydroxy-4H-chromen-4-one | ||||||
 要素 要素 | Protein polybromo-1 | ||||||
 キーワード キーワード | TRANSCRIPTION / bromodomain / complex / small molecule / structural genomics consortium / SGC | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of G0 to G1 transition / regulation of nucleotide-excision repair / RSC-type complex / regulation of mitotic metaphase/anaphase transition / SWI/SNF complex / positive regulation of double-strand break repair / positive regulation of T cell differentiation / nuclear chromosome / RUNX1 interacts with co-factors whose precise effect on RUNX1 targets is not known / regulation of G1/S transition of mitotic cell cycle ...regulation of G0 to G1 transition / regulation of nucleotide-excision repair / RSC-type complex / regulation of mitotic metaphase/anaphase transition / SWI/SNF complex / positive regulation of double-strand break repair / positive regulation of T cell differentiation / nuclear chromosome / RUNX1 interacts with co-factors whose precise effect on RUNX1 targets is not known / regulation of G1/S transition of mitotic cell cycle / positive regulation of myoblast differentiation / transcription elongation by RNA polymerase II / positive regulation of cell differentiation / kinetochore / RMTs methylate histone arginines / nuclear matrix / mitotic cell cycle / chromatin remodeling / negative regulation of cell population proliferation / chromatin binding / chromatin / regulation of transcription by RNA polymerase II / DNA binding / nucleoplasm / nucleus 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.4 Å 分子置換 / 解像度: 2.4 Å | ||||||
 データ登録者 データ登録者 | Filippakopoulos, P. / Picaud, S. / Felletar, I. / von Delft, F. / Edwards, A.M. / Arrowsmith, C.H. / Bountra, C. / Knapp, S. | ||||||
| 資金援助 |  英国, 1件 英国, 1件
| ||||||
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2016 ジャーナル: J.Med.Chem. / 年: 2016タイトル: Discovery and Optimization of a Selective Ligand for the Switch/Sucrose Nonfermenting-Related Bromodomains of Polybromo Protein-1 by the Use of Virtual Screening and Hydration Analysis. 著者: Myrianthopoulos, V. / Gaboriaud-Kolar, N. / Tallant, C. / Hall, M.L. / Grigoriou, S. / Brownlee, P.M. / Fedorov, O. / Rogers, C. / Heidenreich, D. / Wanior, M. / Drosos, N. / Mexia, N. / ...著者: Myrianthopoulos, V. / Gaboriaud-Kolar, N. / Tallant, C. / Hall, M.L. / Grigoriou, S. / Brownlee, P.M. / Fedorov, O. / Rogers, C. / Heidenreich, D. / Wanior, M. / Drosos, N. / Mexia, N. / Savitsky, P. / Bagratuni, T. / Kastritis, E. / Terpos, E. / Filippakopoulos, P. / Muller, S. / Skaltsounis, A.L. / Downs, J.A. / Knapp, S. / Mikros, E. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5iid.cif.gz 5iid.cif.gz | 109.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5iid.ent.gz pdb5iid.ent.gz | 84.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5iid.json.gz 5iid.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5iid_validation.pdf.gz 5iid_validation.pdf.gz | 902.9 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5iid_full_validation.pdf.gz 5iid_full_validation.pdf.gz | 903.6 KB | 表示 | |
| XML形式データ |  5iid_validation.xml.gz 5iid_validation.xml.gz | 11.1 KB | 表示 | |
| CIF形式データ |  5iid_validation.cif.gz 5iid_validation.cif.gz | 14.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ii/5iid https://data.pdbj.org/pub/pdb/validation_reports/ii/5iid ftp://data.pdbj.org/pub/pdb/validation_reports/ii/5iid ftp://data.pdbj.org/pub/pdb/validation_reports/ii/5iid | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5hrvC  5hrwC  5hrxC  5ii1C  5ii2C  2grcS  2ossS  2ouoS  3d7cS  3daiS  3dwyS  3hmhS  3mb4S S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||
| 2 | 
| ||||||||||||||||||
| 単位格子 |
| ||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Component-ID: _ / Ens-ID: 1 / Beg auth comp-ID: SER / Beg label comp-ID: SER / End auth comp-ID: ASP / End label comp-ID: ASP / Refine code: _ / Auth seq-ID: 652 - 766 / Label seq-ID: 10 - 124
|
- 要素
要素
| #1: タンパク質 | 分子量: 14648.000 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PBRM1, BAF180, PB1 / プラスミド: pNIC28-Bsa4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PBRM1, BAF180, PB1 / プラスミド: pNIC28-Bsa4 / 発現宿主:  #2: 化合物 | #3: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.79 Å3/Da / 溶媒含有率: 55.85 % |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 8.5 詳細: 0.20M Na2SO4 0.1M BTProp pH 8.5 20.0% PEG 3350 10.0% EtGly |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.52 Å 回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.52 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: RIGAKU RAXIS IV / 検出器: IMAGE PLATE / 日付: 2011年7月5日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1.52 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2.4→18.632 Å / Num. obs: 13364 / % possible obs: 99.3 % / 冗長度: 4.6 % / Rmerge(I) obs: 0.104 / Rsym value: 0.104 / Net I/av σ(I): 6.941 / Net I/σ(I): 10.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR | Rfactor: 51.71 / Model details: Phaser MODE: MR_AUTO
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: Ensemble of 3MB4,3DAI,3HMH,2GRC,2OSS,2OUO,3D7C,3DWY 解像度: 2.4→18.6 Å / Cor.coef. Fo:Fc: 0.944 / Cor.coef. Fo:Fc free: 0.923 / SU B: 18.795 / SU ML: 0.216 / SU R Cruickshank DPI: 0.3449 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.345 / ESU R Free: 0.273 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : WITH TLS ADDED
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 124.12 Å2 / Biso mean: 38.291 Å2 / Biso min: 19.62 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 2.4→18.6 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | Ens-ID: 1 / 数: 4275 / Refine-ID: X-RAY DIFFRACTION / タイプ: interatomic distance / Rms dev position: 0.13 Å / Weight position: 0.05
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.4→2.461 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj