[English] 日本語
 Yorodumi
Yorodumi- PDB-4b81: Mus musculus Acetylcholinesterase in complex with 1-(4-Chloro-phe... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4b81 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Mus musculus Acetylcholinesterase in complex with 1-(4-Chloro-phenyl)- N-(2-diethylamino-ethyl)-methanesulfonamide | |||||||||
 Components Components | ACETYLCHOLINESTERASE | |||||||||
 Keywords Keywords | HYDROLASE / INHIBITOR | |||||||||
| Function / homology |  Function and homology information Function and homology informationacetylcholine metabolic process / serine hydrolase activity / acetylcholine catabolic process / acetylcholinesterase / positive regulation of dendrite morphogenesis / cholinesterase activity / choline metabolic process / acetylcholine binding / osteoblast development / acetylcholine receptor signaling pathway ...acetylcholine metabolic process / serine hydrolase activity / acetylcholine catabolic process / acetylcholinesterase / positive regulation of dendrite morphogenesis / cholinesterase activity / choline metabolic process / acetylcholine binding / osteoblast development / acetylcholine receptor signaling pathway / acetylcholinesterase activity / positive regulation of axonogenesis / basement membrane / regulation of receptor recycling / synaptic cleft / side of membrane / collagen binding / synapse assembly / laminin binding / neuromuscular junction / receptor internalization / response to insulin / nuclear envelope / positive regulation of cold-induced thermogenesis / retina development in camera-type eye / presynaptic membrane / postsynaptic membrane / cell adhesion / membrane raft / endoplasmic reticulum lumen / hydrolase activity / axon / neuronal cell body / synapse / dendrite / perinuclear region of cytoplasm / cell surface / Golgi apparatus / protein homodimerization activity / extracellular space / extracellular region / identical protein binding / membrane / plasma membrane Similarity search - Function | |||||||||
| Biological species |  | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  FOURIER SYNTHESIS / Resolution: 2.8 Å FOURIER SYNTHESIS / Resolution: 2.8 Å | |||||||||
 Authors Authors | Andersson, C.D. / Forsgren, N. / Akfur, C. / Allgardsson, A. / Berg, L. / Qian, W. / Ekstrom, F. / Linusson, A. | |||||||||
 Citation Citation |  Journal: J.Med.Chem. / Year: 2013 Journal: J.Med.Chem. / Year: 2013Title: Divergent Structure-Activity Relationships of Structurally Similar Acetylcholinesterase Inhibitors. Authors: Andersson, C.D. / Forsgren, N. / Akfur, C. / Allgardsson, A. / Berg, L. / Engdahl, C. / Qian, W. / Ekstrom, F.J. / Linusson, A. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4b81.cif.gz 4b81.cif.gz | 429.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4b81.ent.gz pdb4b81.ent.gz | 355.2 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4b81.json.gz 4b81.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/b8/4b81 https://data.pdbj.org/pub/pdb/validation_reports/b8/4b81 ftp://data.pdbj.org/pub/pdb/validation_reports/b8/4b81 ftp://data.pdbj.org/pub/pdb/validation_reports/b8/4b81 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4b7zC  4b80C  4b82C  4b83C  4b84C  4b85C  4btlC  1j06S S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein / Sugars , 2 types, 5 molecules AB

| #1: Protein | Mass: 60233.984 Da / Num. of mol.: 2 / Fragment: CATALYTIC DOMAIN, RESIDUES 32-574 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   HOMO SAPIENS (human) / References: UniProt: P21836, acetylcholinesterase HOMO SAPIENS (human) / References: UniProt: P21836, acetylcholinesterase#4: Sugar | |
|---|
-Non-polymers , 5 types, 193 molecules 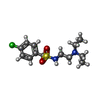


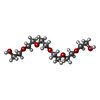





| #2: Chemical | | #3: Chemical | #5: Chemical | ChemComp-PEG / #6: Chemical | ChemComp-P6G / | #7: Water | ChemComp-HOH / | |
|---|
-Details
| Has protein modification | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.1 Å3/Da / Density % sol: 41 % / Description: NONE |
|---|---|
| Crystal grow | pH: 7 / Details: 27-31 % (W/V)PEG750 MME, 0.1 M HEPES PH 7.0-7.1 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  MAX II MAX II  / Beamline: I911-3 / Wavelength: 1.039 / Beamline: I911-3 / Wavelength: 1.039 |
| Detector | Type: MARRESEARCH / Detector: CCD / Date: Jan 21, 2011 / Details: MIRRORS |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.039 Å / Relative weight: 1 |
| Reflection | Resolution: 2.8→29.3 Å / Num. obs: 49067 / % possible obs: 99.9 % / Observed criterion σ(I): 3 / Redundancy: 4.1 % / Biso Wilson estimate: 52.86 Å2 / Rmerge(I) obs: 0.09 / Net I/σ(I): 13.7 |
| Reflection shell | Resolution: 2.8→2.95 Å / Redundancy: 4 % / Rmerge(I) obs: 0.52 / Mean I/σ(I) obs: 2.8 / % possible all: 100 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  FOURIER SYNTHESIS FOURIER SYNTHESISStarting model: PDB ENTRY 1J06 Resolution: 2.8→29.003 Å / SU ML: 0.39 / σ(F): 1.34 / Phase error: 27.25 / Stereochemistry target values: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.73 Å / VDW probe radii: 1 Å / Solvent model: FLAT BULK SOLVENT MODEL / Bsol: 43.069 Å2 / ksol: 0.328 e/Å3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 63 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.8→29.003 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller










































































 PDBj
PDBj





