Entry Database : PDB / ID : 2wu3Title CRYSTAL STRUCTURE OF MOUSE ACETYLCHOLINESTERASE IN COMPLEX WITH FENAMIPHOS AND HI-6 ACETYLCHOLINESTERASE Keywords / / / / / / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species MUS MUSCULUS (house mouse)Method / / / Resolution : 2.7 Å Authors Hornberg, A. / Artursson, E. / Warme, R. / Pang, Y.-P. / Ekstrom, F. Journal : Biochem.Pharm. / Year : 2010Title : Crystal Structures of Oxime-Bound Fenamiphos-Acetylcholinesterases: Reactivation Involving Flipping of the His447 Ring to Form a Reactive Glu334-His447-Oxime Triad.Authors : Hornberg, A. / Artursson, E. / Warme, R. / Pang, Y.-P. / Ekstrom, F. History Deposition Sep 28, 2009 Deposition site / Processing site Revision 1.0 Oct 20, 2009 Provider / Type Revision 1.1 May 8, 2011 Group Revision 1.2 Jul 13, 2011 Group Revision 1.3 Jul 12, 2017 Group / Data collection / Derived calculations / Category / diffrn_source / struct_connItem _diffrn_source.pdbx_synchrotron_site / _struct_conn.pdbx_dist_value ... _diffrn_source.pdbx_synchrotron_site / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_ptnr1_label_alt_id / _struct_conn.pdbx_ptnr2_label_alt_id / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id Revision 2.0 May 15, 2019 Group / Derived calculations / Polymer sequenceCategory entity_poly / pdbx_seq_map_depositor_info ... entity_poly / pdbx_seq_map_depositor_info / pdbx_struct_sheet_hbond / struct_conf / struct_sheet / struct_sheet_order / struct_sheet_range / struct_site / struct_site_gen Item _entity_poly.pdbx_seq_one_letter_code_can / _pdbx_seq_map_depositor_info.one_letter_code ... _entity_poly.pdbx_seq_one_letter_code_can / _pdbx_seq_map_depositor_info.one_letter_code / _struct_sheet.id / _struct_sheet.number_strands / _struct_site.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id / _struct_site.pdbx_num_residues / _struct_site_gen.auth_asym_id / _struct_site_gen.auth_comp_id / _struct_site_gen.auth_seq_id / _struct_site_gen.label_asym_id / _struct_site_gen.label_comp_id / _struct_site_gen.label_seq_id / _struct_site_gen.pdbx_num_res / _struct_site_gen.site_id Revision 2.1 Jul 29, 2020 Group Data collection / Derived calculations ... Data collection / Derived calculations / Other / Structure summary Category chem_comp / entity ... chem_comp / entity / pdbx_chem_comp_identifier / pdbx_database_status / pdbx_entity_nonpoly / struct_conn / struct_site / struct_site_gen Item _chem_comp.name / _chem_comp.type ... _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_database_status.status_code_sf / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_role Description / Provider / Type Revision 2.2 May 12, 2021 Group / Structure summaryCategory chem_comp / pdbx_struct_assembly ... chem_comp / pdbx_struct_assembly / pdbx_struct_assembly_gen / pdbx_struct_assembly_prop Item Revision 2.3 Dec 20, 2023 Group / Database references / Refinement descriptionCategory chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_database_accession
Show all Show less
 Yorodumi
Yorodumi Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information
 X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.7 Å
MOLECULAR REPLACEMENT / Resolution: 2.7 Å  Authors
Authors Citation
Citation Journal: Biochem.Pharm. / Year: 2010
Journal: Biochem.Pharm. / Year: 2010 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 2wu3.cif.gz
2wu3.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb2wu3.ent.gz
pdb2wu3.ent.gz PDB format
PDB format 2wu3.json.gz
2wu3.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/wu/2wu3
https://data.pdbj.org/pub/pdb/validation_reports/wu/2wu3 ftp://data.pdbj.org/pub/pdb/validation_reports/wu/2wu3
ftp://data.pdbj.org/pub/pdb/validation_reports/wu/2wu3

 Links
Links Assembly
Assembly

 Components
Components


 HOMO SAPIENS (human) / References: UniProt: P21836, acetylcholinesterase
HOMO SAPIENS (human) / References: UniProt: P21836, acetylcholinesterase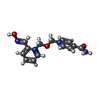





 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  MAX II
MAX II  / Beamline: I911-5 / Wavelength: 0.90736
/ Beamline: I911-5 / Wavelength: 0.90736  Processing
Processing MOLECULAR REPLACEMENT
MOLECULAR REPLACEMENT Movie
Movie Controller
Controller


























































 PDBj
PDBj








