+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
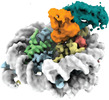
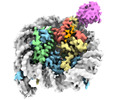
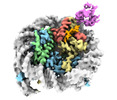
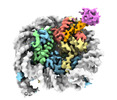
| タイトル | Cryo-EM structure of the human nucleosome core particle in complex with RNF168-UbcH5c | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Nucleosome core particle / chromatin / RNF168 / RING domain / UbcH5c / DNA repair / DNA double-strand break / Homologous recombination / 53BP1 / BRCA1-BARD1 / ubiquitin / STRUCTURAL PROTEIN-DNA-TRANSFERASE complex / TRANSFERASE / TRANSFERASE-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報histone H2AK15 ubiquitin ligase activity / histone ubiquitin ligase activity / (E3-independent) E2 ubiquitin-conjugating enzyme / Signaling by BMP / protein K6-linked ubiquitination / isotype switching / double-strand break repair via classical nonhomologous end joining / protein K11-linked ubiquitination / DNA repair-dependent chromatin remodeling / negative regulation of BMP signaling pathway ...histone H2AK15 ubiquitin ligase activity / histone ubiquitin ligase activity / (E3-independent) E2 ubiquitin-conjugating enzyme / Signaling by BMP / protein K6-linked ubiquitination / isotype switching / double-strand break repair via classical nonhomologous end joining / protein K11-linked ubiquitination / DNA repair-dependent chromatin remodeling / negative regulation of BMP signaling pathway / positive regulation of protein targeting to mitochondrion / E2 ubiquitin-conjugating enzyme / K63-linked polyubiquitin modification-dependent protein binding / response to ionizing radiation / negative regulation of transcription elongation by RNA polymerase II / protein monoubiquitination / protein localization to CENP-A containing chromatin / ubiquitin conjugating enzyme activity / protein K63-linked ubiquitination / CENP-A containing nucleosome / negative regulation of tumor necrosis factor-mediated signaling pathway / Replacement of protamines by nucleosomes in the male pronucleus / arachidonate 15-lipoxygenase / arachidonate 15-lipoxygenase activity / positive regulation of DNA repair / nucleosome binding / Packaging Of Telomere Ends / protein K48-linked ubiquitination / protein autoubiquitination / lipoxygenase pathway / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / telomere organization / arachidonate metabolic process / Chromatin modifying enzymes / lipid oxidation / SUMOylation of DNA damage response and repair proteins / interstrand cross-link repair / Deposition of new CENPA-containing nucleosomes at the centromere / hepoxilin biosynthetic process / ubiquitin ligase complex / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / linoleic acid metabolic process / Meiotic synapsis / Inhibition of DNA recombination at telomere / nucleosomal DNA binding / RNA Polymerase I Promoter Opening / Assembly of the ORC complex at the origin of replication / Interleukin-7 signaling / epigenetic regulation of gene expression / DNA methylation / Condensation of Prophase Chromosomes / HCMV Late Events / TICAM1, RIP1-mediated IKK complex recruitment / SIRT1 negatively regulates rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / PRC2 methylates histones and DNA / IKK complex recruitment mediated by RIP1 / Defective pyroptosis / Meiotic recombination / innate immune response in mucosa / DNA Damage/Telomere Stress Induced Senescence / ubiquitin binding / HDACs deacetylate histones / Nonhomologous End-Joining (NHEJ) / RNA Polymerase I Promoter Escape / Negative regulators of DDX58/IFIH1 signaling / Transcriptional regulation by small RNAs / lipopolysaccharide binding / Transcriptional regulation of granulopoiesis / Peroxisomal protein import / HDMs demethylate histones / Regulation of TNFR1 signaling / Downregulation of SMAD2/3:SMAD4 transcriptional activity / Formation of the beta-catenin:TCF transactivating complex / HCMV Early Events / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / G2/M DNA damage checkpoint / NoRC negatively regulates rRNA expression / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / PKMTs methylate histone lysines / protein modification process / RING-type E3 ubiquitin transferase / B-WICH complex positively regulates rRNA expression / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / Inactivation of CSF3 (G-CSF) signaling / heterochromatin formation / RMTs methylate histone arginines / Pre-NOTCH Transcription and Translation / Metalloprotease DUBs / Activation of anterior HOX genes in hindbrain development during early embryogenesis / double-strand break repair via nonhomologous end joining / structural constituent of chromatin / protein polyubiquitination / ubiquitin-protein transferase activity / UCH proteinases / nucleosome / ubiquitin protein ligase activity 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Hu Q / Botuyan MV / Zhao D / Cui G / Mer G | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2024 ジャーナル: Mol Cell / 年: 2024タイトル: Mechanisms of RNF168 nucleosome recognition and ubiquitylation. 著者: Qi Hu / Debiao Zhao / Gaofeng Cui / Janarjan Bhandari / James R Thompson / Maria Victoria Botuyan / Georges Mer /  要旨: RNF168 plays a central role in the DNA damage response (DDR) by ubiquitylating histone H2A at K13 and K15. These modifications direct BRCA1-BARD1 and 53BP1 foci formation in chromatin, essential for ...RNF168 plays a central role in the DNA damage response (DDR) by ubiquitylating histone H2A at K13 and K15. These modifications direct BRCA1-BARD1 and 53BP1 foci formation in chromatin, essential for cell-cycle-dependent DNA double-strand break (DSB) repair pathway selection. The mechanism by which RNF168 catalyzes the targeted accumulation of H2A ubiquitin conjugates to form repair foci around DSBs remains unclear. Here, using cryoelectron microscopy (cryo-EM), nuclear magnetic resonance (NMR) spectroscopy, and functional assays, we provide a molecular description of the reaction cycle and dynamics of RNF168 as it modifies the nucleosome and recognizes its ubiquitylation products. We demonstrate an interaction of a canonical ubiquitin-binding domain within full-length RNF168, which not only engages ubiquitin but also the nucleosome surface, clarifying how such site-specific ubiquitin recognition propels a signal amplification loop. Beyond offering mechanistic insights into a key DDR protein, our study aids in understanding site specificity in both generating and interpreting chromatin ubiquitylation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42446.map.gz emd_42446.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42446-v30.xml emd-42446-v30.xml emd-42446.xml emd-42446.xml | 28.5 KB 28.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_42446.png emd_42446.png | 162.2 KB | ||
| マスクデータ |  emd_42446_msk_1.map emd_42446_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-42446.cif.gz emd-42446.cif.gz | 7.5 KB | ||
| その他 |  emd_42446_additional_1.map.gz emd_42446_additional_1.map.gz emd_42446_half_map_1.map.gz emd_42446_half_map_1.map.gz emd_42446_half_map_2.map.gz emd_42446_half_map_2.map.gz | 32.2 MB 59.5 MB 59.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42446 http://ftp.pdbj.org/pub/emdb/structures/EMD-42446 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42446 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42446 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8upfMC  8smwC  8smxC  8smyC  8smzC  8sn0C  8sn1C  8sn2C  8sn3C  8sn4C  8sn5C  8sn6C  8sn7C  8sn8C  8sn9C  8snaC  8txvC  8txwC  8txxC  8u13C  8u14C  8uq8C  8uq9C  8uqaC  8uqbC  8uqcC  8uqdC  8uqeC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42446.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42446.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.0276 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_42446_msk_1.map emd_42446_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
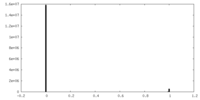
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_42446_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
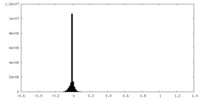
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_42446_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
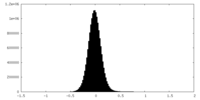
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_42446_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
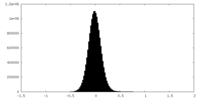
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Human nucleosome core particle in complex with RNF168-UbcH5c
+超分子 #1: Human nucleosome core particle in complex with RNF168-UbcH5c
+分子 #1: Histone H3.1
+分子 #2: Histone H4
+分子 #3: Histone H2B type 1-J
+分子 #6: E3 ubiquitin-protein ligase RNF168
+分子 #7: Ubiquitin-conjugating enzyme E2 D3
+分子 #8: Histone H2A type 1-B/E
+分子 #4: DNA (147-MER)
+分子 #5: DNA (147-MER)
+分子 #9: ZINC ION
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | 10 mM HEPES, 100 mM NaCl, 1 mM DTT, pH 7.5 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 4867 / 平均電子線量: 50.0 e/Å2 詳細: 4867 images were recorded in movie-mode of which 4644 were retained for particle picking. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 22500 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT | ||||||||||||
| 得られたモデル |  PDB-8upf: |
 ムービー
ムービー コントローラー
コントローラー


































 Z
Z Y
Y X
X