+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11176 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the native full-length HIV-1 capsid protein in complex with Cyclophilin A from helical assembly (-13,10) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Synthesis And Processing Of GAG, GAGPOL Polyproteins / host cellular component / host cell nuclear membrane / negative regulation of protein K48-linked ubiquitination / regulation of apoptotic signaling pathway / cell adhesion molecule production / negative regulation of viral life cycle / lipid droplet organization / heparan sulfate binding / regulation of viral genome replication ...Synthesis And Processing Of GAG, GAGPOL Polyproteins / host cellular component / host cell nuclear membrane / negative regulation of protein K48-linked ubiquitination / regulation of apoptotic signaling pathway / cell adhesion molecule production / negative regulation of viral life cycle / lipid droplet organization / heparan sulfate binding / regulation of viral genome replication / virion binding / leukocyte chemotaxis / endothelial cell activation / negative regulation of stress-activated MAPK cascade / Basigin interactions / Integration of viral DNA into host genomic DNA / Autointegration results in viral DNA circles / cyclosporin A binding / Minus-strand DNA synthesis / Plus-strand DNA synthesis / 2-LTR circle formation / Uncoating of the HIV Virion / viral budding via host ESCRT complex / Early Phase of HIV Life Cycle / Vpr-mediated nuclear import of PICs / Integration of provirus / APOBEC3G mediated resistance to HIV-1 infection / viral release from host cell / protein peptidyl-prolyl isomerization / Calcineurin activates NFAT / Binding and entry of HIV virion / viral process / positive regulation of viral genome replication / negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway / : / Membrane binding and targetting of GAG proteins / neutrophil chemotaxis / activation of protein kinase B activity / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / negative regulation of protein phosphorylation / peptidylprolyl isomerase / positive regulation of protein secretion / peptidyl-prolyl cis-trans isomerase activity / negative regulation of protein kinase activity / Assembly Of The HIV Virion / Budding and maturation of HIV virion / neuron differentiation / host multivesicular body / platelet activation / platelet aggregation / SARS-CoV-1 activates/modulates innate immune responses / unfolded protein binding / integrin binding / protein folding / Platelet degranulation / viral capsid / positive regulation of NF-kappaB transcription factor activity / cellular response to oxidative stress / viral nucleocapsid / secretory granule lumen / vesicle / ficolin-1-rich granule lumen / positive regulation of MAPK cascade / positive regulation of protein phosphorylation / viral translational frameshifting / focal adhesion / Neutrophil degranulation / apoptotic process / host cell plasma membrane / structural molecule activity / virion membrane / protein-containing complex / RNA binding / extracellular space / extracellular exosome / zinc ion binding / extracellular region / identical protein binding / membrane / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) / Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
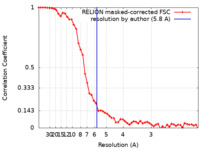
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.8 Å | |||||||||
 データ登録者 データ登録者 | Ni T / Gerard S / Zhao G / Ning J / Zhang P | |||||||||
| 資金援助 |  英国, 英国,  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2020 ジャーナル: Nat Struct Mol Biol / 年: 2020タイトル: Intrinsic curvature of the HIV-1 CA hexamer underlies capsid topology and interaction with cyclophilin A. 著者: Tao Ni / Samuel Gerard / Gongpu Zhao / Kyle Dent / Jiying Ning / Jing Zhou / Jiong Shi / Jordan Anderson-Daniels / Wen Li / Sooin Jang / Alan N Engelman / Christopher Aiken / Peijun Zhang /   要旨: The mature retrovirus capsid consists of a variably curved lattice of capsid protein (CA) hexamers and pentamers. High-resolution structures of the curved assembly, or in complex with host factors, ...The mature retrovirus capsid consists of a variably curved lattice of capsid protein (CA) hexamers and pentamers. High-resolution structures of the curved assembly, or in complex with host factors, have not been available. By devising cryo-EM methodologies for exceedingly flexible and pleomorphic assemblies, we have determined cryo-EM structures of apo-CA hexamers and in complex with cyclophilin A (CypA) at near-atomic resolutions. The CA hexamers are intrinsically curved, flexible and asymmetric, revealing the capsomere and not the previously touted dimer or trimer interfaces as the key contributor to capsid curvature. CypA recognizes specific geometries of the curved lattice, simultaneously interacting with three CA protomers from adjacent hexamers via two noncanonical interfaces, thus stabilizing the capsid. By determining multiple structures from various helical symmetries, we further revealed the essential plasticity of the CA molecule, which allows formation of continuously curved conical capsids and the mechanism of capsid pattern sensing by CypA. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11176.map.gz emd_11176.map.gz | 4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11176-v30.xml emd-11176-v30.xml emd-11176.xml emd-11176.xml | 19.2 KB 19.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_11176_fsc.xml emd_11176_fsc.xml | 5.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_11176.png emd_11176.png | 84.8 KB | ||
| その他 |  emd_11176_half_map_1.map.gz emd_11176_half_map_1.map.gz emd_11176_half_map_2.map.gz emd_11176_half_map_2.map.gz | 9.9 MB 9.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11176 http://ftp.pdbj.org/pub/emdb/structures/EMD-11176 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11176 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11176 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11176_validation.pdf.gz emd_11176_validation.pdf.gz | 405 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11176_full_validation.pdf.gz emd_11176_full_validation.pdf.gz | 404.1 KB | 表示 | |
| XML形式データ |  emd_11176_validation.xml.gz emd_11176_validation.xml.gz | 10.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11176 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11176 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11176 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11176 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6zdjMC  6skkC  6skmC  6sknC  6slqC  6sluC  6smuC  6y9vC  6y9wC  6y9xC  6y9yC  6y9zC  6yj5C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11176.map.gz / 形式: CCP4 / 大きさ: 11.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11176.map.gz / 形式: CCP4 / 大きさ: 11.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #1
| ファイル | emd_11176_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_11176_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : In vitro assembled HIV-1 capsid in tubular assembly
| 全体 | 名称: In vitro assembled HIV-1 capsid in tubular assembly |
|---|---|
| 要素 |
|
-超分子 #1: In vitro assembled HIV-1 capsid in tubular assembly
| 超分子 | 名称: In vitro assembled HIV-1 capsid in tubular assembly / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|
-超分子 #2: HIV-1 capsid
| 超分子 | 名称: HIV-1 capsid / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
| 組換発現 | 生物種:  |
-超分子 #3: Cyclophilin A
| 超分子 | 名称: Cyclophilin A / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-分子 #1: Gag protein
| 分子 | 名称: Gag protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
| 分子量 | 理論値: 24.531094 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: PIVQNIQGQM VHQAISPRTL NAWVKVVEEK AFSPEVIPMF SALSEGATPQ DLNTMLNTVG GHQAAMQMLK ETINEEAAEW DRVHPVHAG PIAPGQMREP RGSDIAGTTS TLQEQIGWMT NNPPIPVGEI YKRWIILGLN KIVRMYSPTS ILDIRQGPKE P FRDYVDRF ...文字列: PIVQNIQGQM VHQAISPRTL NAWVKVVEEK AFSPEVIPMF SALSEGATPQ DLNTMLNTVG GHQAAMQMLK ETINEEAAEW DRVHPVHAG PIAPGQMREP RGSDIAGTTS TLQEQIGWMT NNPPIPVGEI YKRWIILGLN KIVRMYSPTS ILDIRQGPKE P FRDYVDRF YKTLRAEQAS QEVKNWMTET LLVQNANPDC KTILKALGPA ATLEEMMTAC QG |
-分子 #2: Peptidyl-prolyl cis-trans isomerase A
| 分子 | 名称: Peptidyl-prolyl cis-trans isomerase A / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO / EC番号: peptidylprolyl isomerase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 17.905307 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: VNPTVFFDIA VDGEPLGRVS FELFADKVPK TAENFRALST GEKGFGYKGS CFHRIIPGFM CQGGDFTRHN GTGGKSIYGE KFEDENFIL KHTGPGILSM ANAGPNTNGS QFFICTAKTE WLDGKHVVFG KVKEGMNIVE AMERFGSRNG KTSKKITIAD C GQLE |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 濃度 | 2 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: Quantifoil R2/1 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY |
| 凍結 | 凍結剤: ETHANE |
| 詳細 | Purified capsid protein were assembled in the presence of Cyclophilin A. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 実像数: 6500 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)