+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4336 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of two molecules of the chromatin remodelling enzyme Chd1 bound to a nucleosome | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nucleolar chromatin / regulation of transcriptional start site selection at RNA polymerase II promoter / negative regulation of DNA-templated DNA replication / regulation of chromatin organization / nucleosome organization /  rDNA binding / SLIK (SAGA-like) complex / SAGA complex / ATP-dependent chromatin remodeler activity / sister chromatid cohesion ...nucleolar chromatin / regulation of transcriptional start site selection at RNA polymerase II promoter / negative regulation of DNA-templated DNA replication / regulation of chromatin organization / nucleosome organization / rDNA binding / SLIK (SAGA-like) complex / SAGA complex / ATP-dependent chromatin remodeler activity / sister chromatid cohesion ...nucleolar chromatin / regulation of transcriptional start site selection at RNA polymerase II promoter / negative regulation of DNA-templated DNA replication / regulation of chromatin organization / nucleosome organization /  rDNA binding / SLIK (SAGA-like) complex / SAGA complex / ATP-dependent chromatin remodeler activity / sister chromatid cohesion / termination of RNA polymerase II transcription / termination of RNA polymerase I transcription / ATP-dependent activity, acting on DNA / methylated histone binding / rDNA binding / SLIK (SAGA-like) complex / SAGA complex / ATP-dependent chromatin remodeler activity / sister chromatid cohesion / termination of RNA polymerase II transcription / termination of RNA polymerase I transcription / ATP-dependent activity, acting on DNA / methylated histone binding /  helicase activity / transcription elongation by RNA polymerase II / DNA-templated transcription initiation / helicase activity / transcription elongation by RNA polymerase II / DNA-templated transcription initiation /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / chromatin DNA binding / structural constituent of chromatin / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / chromatin DNA binding / structural constituent of chromatin /  ヌクレオソーム / ヌクレオソーム /  histone binding / transcription cis-regulatory region binding / histone binding / transcription cis-regulatory region binding /  クロマチンリモデリング / protein heterodimerization activity / クロマチンリモデリング / protein heterodimerization activity /  chromatin binding / chromatin binding /  クロマチン / regulation of transcription by RNA polymerase II / クロマチン / regulation of transcription by RNA polymerase II /  ATP hydrolysis activity / ATP hydrolysis activity /  ミトコンドリア / ミトコンドリア /  DNA binding / DNA binding /  ATP binding / ATP binding /  細胞核 細胞核類似検索 - 分子機能 | |||||||||
| 生物種 |  Xenopus laevis (アフリカツメガエル) / synthetic construct (人工物) / Xenopus laevis (アフリカツメガエル) / synthetic construct (人工物) /   Saccharomyces cerevisiae S288C (パン酵母) Saccharomyces cerevisiae S288C (パン酵母) | |||||||||
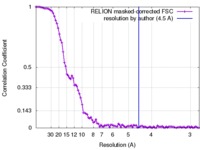
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 10.0 Å クライオ電子顕微鏡法 / 解像度: 10.0 Å | |||||||||
 データ登録者 データ登録者 | Sundaramoorthy R / Owen-hughes T / Norman DG / Hughes A | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2018 ジャーナル: Elife / 年: 2018タイトル: Structure of the chromatin remodelling enzyme Chd1 bound to a ubiquitinylated nucleosome. 著者: Ramasubramanian Sundaramoorthy / Amanda L Hughes / Hassane El-Mkami / David G Norman / Helder Ferreira / Tom Owen-Hughes /  要旨: ATP-dependent chromatin remodelling proteins represent a diverse family of proteins that share ATPase domains that are adapted to regulate protein-DNA interactions. Here, we present structures of the ...ATP-dependent chromatin remodelling proteins represent a diverse family of proteins that share ATPase domains that are adapted to regulate protein-DNA interactions. Here, we present structures of the Chd1 protein engaged with nucleosomes in the presence of the transition state mimic ADP-beryllium fluoride. The path of DNA strands through the ATPase domains indicates the presence of contacts conserved with single strand translocases and additional contacts with both strands that are unique to Snf2 related proteins. The structure provides connectivity between rearrangement of ATPase lobes to a closed, nucleotide bound state and the sensing of linker DNA. Two turns of linker DNA are prised off the surface of the histone octamer as a result of Chd1 binding, and both the histone H3 tail and ubiquitin conjugated to lysine 120 are re-orientated towards the unravelled DNA. This indicates how changes to nucleosome structure can alter the way in which histone epitopes are presented. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4336.map.gz emd_4336.map.gz | 55.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4336-v30.xml emd-4336-v30.xml emd-4336.xml emd-4336.xml | 27 KB 27 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4336_fsc.xml emd_4336_fsc.xml | 9.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4336.png emd_4336.png | 138.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4336 http://ftp.pdbj.org/pub/emdb/structures/EMD-4336 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4336 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4336 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4336.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4336.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.42 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
+全体 : X. laevis nucleosome pn 601 DNA with S.cerevisiae remodeller Chd1
+超分子 #1: X. laevis nucleosome pn 601 DNA with S.cerevisiae remodeller Chd1
+超分子 #2: X. laevis nucleosome pn 601 DNA with S.cerevisiae remodeller Chd1
+超分子 #3: X. laevis nucleosome pn 601 DNA with S.cerevisiae remodeller Chd1
+超分子 #4: X. laevis nucleosome pn 601 DNA with S.cerevisiae remodeller Chd1
+分子 #1: Histone H3
+分子 #2: Histone H4
+分子 #3: Histone H2A type 1
+分子 #4: Histone H4
+分子 #5: Histone H2A type 1
+分子 #8: Chromo domain-containing protein 1
+分子 #6: DNA (176-MER)
+分子 #7: DNA (177-MER)
+分子 #9: ADENOSINE-5'-DIPHOSPHATE
+分子 #10: BERYLLIUM TRIFLUORIDE ION
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL | ||||||
|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||
| グリッド | モデル: C-flat-1.2/1.3 4C / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: OTHER | ||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK III | ||||||
| 詳細 | Sample was gel filtration purified and it is monodisperse |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 最大 デフォーカス(補正後): 4.0 µm / 最小 デフォーカス(補正後): 1.5 µm / 倍率(補正後): 98591 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 98591 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 98591 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 温度 | 最低: 170.0 K / 最高: 170.0 K |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: INTEGRATING / デジタル化 - サイズ - 横: 3870 pixel / デジタル化 - サイズ - 縦: 3870 pixel / デジタル化 - サンプリング間隔: 14.0 µm / デジタル化 - 画像ごとのフレーム数: 5-28 / 撮影したグリッド数: 1 / 実像数: 1800 / 平均露光時間: 2.0 sec. / 平均電子線量: 1.56 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: RIGID BODY FIT / 温度因子: 800 当てはまり具合の基準: Cross-correlation coefficient |
|---|---|
| 得られたモデル |  PDB-6g0l: |
 ムービー
ムービー コントローラー
コントローラー