+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-0468 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Poised-state Dot1L bound to the H2B-Ubiquitinated nucleosome | |||||||||
 マップデータ マップデータ | Sharpened map of poised state dot1L bound to the H2B-Ub nucleosome | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Ubiquitin (ユビキチン) / Ubiquitin (ユビキチン) /  Nucleosome (ヌクレオソーム) / Nucleosome (ヌクレオソーム) /  Methyltransferase (メチルトランスフェラーゼ) / Methyltransferase (メチルトランスフェラーゼ) /  STRUCTURAL PROTEIN-TRANSFERASE-DNA complex (構造) STRUCTURAL PROTEIN-TRANSFERASE-DNA complex (構造) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / histone H3K79 trimethyltransferase activity / [histone H3]-lysine79 N-trimethyltransferase / histone H3K79 methyltransferase activity / regulation of transcription regulatory region DNA binding / regulation of receptor signaling pathway via JAK-STAT / histone H3 methyltransferase activity /  histone methyltransferase activity / heterochromatin formation / telomere organization ...: / histone H3K79 trimethyltransferase activity / [histone H3]-lysine79 N-trimethyltransferase / histone H3K79 methyltransferase activity / regulation of transcription regulatory region DNA binding / regulation of receptor signaling pathway via JAK-STAT / histone H3 methyltransferase activity / histone methyltransferase activity / heterochromatin formation / telomere organization ...: / histone H3K79 trimethyltransferase activity / [histone H3]-lysine79 N-trimethyltransferase / histone H3K79 methyltransferase activity / regulation of transcription regulatory region DNA binding / regulation of receptor signaling pathway via JAK-STAT / histone H3 methyltransferase activity /  histone methyltransferase activity / heterochromatin formation / telomere organization / DNA damage checkpoint signaling / PKMTs methylate histone lysines / structural constituent of chromatin / histone methyltransferase activity / heterochromatin formation / telomere organization / DNA damage checkpoint signaling / PKMTs methylate histone lysines / structural constituent of chromatin /  ヌクレオソーム / ヌクレオソーム /  遺伝子発現 / RNA polymerase II-specific DNA-binding transcription factor binding / 遺伝子発現 / RNA polymerase II-specific DNA-binding transcription factor binding /  nucleic acid binding / nucleic acid binding /  transcription coactivator activity / protein heterodimerization activity / transcription coactivator activity / protein heterodimerization activity /  DNA修復 / intracellular membrane-bounded organelle / positive regulation of cell population proliferation / positive regulation of transcription by RNA polymerase II / protein-containing complex / DNA修復 / intracellular membrane-bounded organelle / positive regulation of cell population proliferation / positive regulation of transcription by RNA polymerase II / protein-containing complex /  DNA binding / DNA binding /  核質 / 核質 /  細胞核 / 細胞核 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) / Homo sapiens (ヒト) /  Xenopus laevis (アフリカツメガエル) / synthetic construct (人工物) Xenopus laevis (アフリカツメガエル) / synthetic construct (人工物) | |||||||||
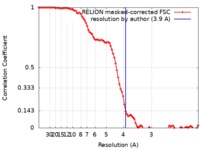
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.9 Å クライオ電子顕微鏡法 / 解像度: 3.9 Å | |||||||||
 データ登録者 データ登録者 | Worden EJ / Hoffmann NA | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2019 ジャーナル: Cell / 年: 2019タイトル: Mechanism of Cross-talk between H2B Ubiquitination and H3 Methylation by Dot1L. 著者: Evan J Worden / Niklas A Hoffmann / Chad W Hicks / Cynthia Wolberger /  要旨: Methylation of histone H3 K79 by Dot1L is a hallmark of actively transcribed genes that depends on monoubiquitination of H2B K120 (H2B-Ub) and is an example of histone modification cross-talk that is ...Methylation of histone H3 K79 by Dot1L is a hallmark of actively transcribed genes that depends on monoubiquitination of H2B K120 (H2B-Ub) and is an example of histone modification cross-talk that is conserved from yeast to humans. We report here cryo-EM structures of Dot1L bound to ubiquitinated nucleosome that show how H2B-Ub stimulates Dot1L activity and reveal a role for the histone H4 tail in positioning Dot1L. We find that contacts mediated by Dot1L and the H4 tail induce a conformational change in the globular core of histone H3 that reorients K79 from an inaccessible position, thus enabling this side chain to insert into the active site in a position primed for catalysis. Our study provides a comprehensive mechanism of cross-talk between histone ubiquitination and methylation and reveals structural plasticity in histones that makes it possible for histone-modifying enzymes to access residues within the nucleosome core. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0468.map.gz emd_0468.map.gz | 5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0468-v30.xml emd-0468-v30.xml emd-0468.xml emd-0468.xml | 36.7 KB 36.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0468_fsc.xml emd_0468_fsc.xml | 9.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0468.png emd_0468.png | 113.4 KB | ||
| マスクデータ |  emd_0468_msk_1.map emd_0468_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-0468.cif.gz emd-0468.cif.gz | 8 KB | ||
| その他 |  emd_0468_additional.map.gz emd_0468_additional.map.gz emd_0468_half_map_1.map.gz emd_0468_half_map_1.map.gz emd_0468_half_map_2.map.gz emd_0468_half_map_2.map.gz | 49.4 MB 59.2 MB 59.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0468 http://ftp.pdbj.org/pub/emdb/structures/EMD-0468 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0468 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0468 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0468.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0468.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map of poised state dot1L bound to the H2B-Ub nucleosome | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.064 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_0468_msk_1.map emd_0468_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Unsharpened map of poised state dot1L bound to the H2B-Ub nucleosome
| ファイル | emd_0468_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map of poised state dot1L bound to the H2B-Ub nucleosome | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Sharpened half map used for structure refinement
| ファイル | emd_0468_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened half map used for structure refinement | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Sharpened half map used for structure validation
| ファイル | emd_0468_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened half map used for structure validation | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Poised state Dot1L in complex with the H2B-Ub nucleosome
+超分子 #1: Poised state Dot1L in complex with the H2B-Ub nucleosome
+超分子 #2: Dot1L
+超分子 #3: H2B-Ub nucleosome
+超分子 #4: histone core
+超分子 #5: ubiquitin
+超分子 #6: DNA
+分子 #1: Histone H3.2
+分子 #2: Histone H4
+分子 #3: Histone H2A type 1
+分子 #4: Histone H2B 1.1
+分子 #5: Ubiquitin
+分子 #6: Histone-lysine N-methyltransferase, H3 lysine-79 specific
+分子 #7: 601 DNA Strand 1
+分子 #8: 601 DNA Strand 2
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.75 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: Solutions were prepared on the day of freezing and filtered though a 0.2 um filter prior to use. | ||||||||||||
| グリッド | モデル: C-flat-2/2 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: Blot once for 3.5 seconds before freezing. | ||||||||||||
| 詳細 | Crosslinked with glutaraldehyde |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 130000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-40 / 撮影したグリッド数: 1 / 実像数: 2267 / 平均露光時間: 9.0 sec. / 平均電子線量: 50.0 e/Å2 / 詳細: 3 exposures per hole |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: OTHER | ||||||||||||||||||||||||||
| 得られたモデル |  PDB-6nog: |
 ムービー
ムービー コントローラー
コントローラー




















 Z
Z Y
Y X
X