+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9cm9 | ||||||
|---|---|---|---|---|---|---|---|
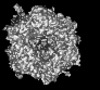
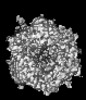
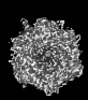
| タイトル | Cryo-EM model derived from localized reconstruction of Ad657-hexon-FX complex at 3.86A resolution | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | VIRAL PROTEIN / Adenovirus / Hexon / Coagulation factor X / Coagulation factor II / Prothrombin / Complex / Interactions / VIRUS | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報T=25 icosahedral viral capsid / coagulation factor Xa / microtubule-dependent intracellular transport of viral material towards nucleus / positive regulation of TOR signaling / Golgi lumen / blood coagulation / host cell / endoplasmic reticulum lumen / serine-type endopeptidase activity / calcium ion binding ...T=25 icosahedral viral capsid / coagulation factor Xa / microtubule-dependent intracellular transport of viral material towards nucleus / positive regulation of TOR signaling / Golgi lumen / blood coagulation / host cell / endoplasmic reticulum lumen / serine-type endopeptidase activity / calcium ion binding / symbiont entry into host cell / host cell nucleus / structural molecule activity / proteolysis / extracellular region 類似検索 - 分子機能 | ||||||
| 生物種 |  Human adenovirus 6 (ヒトアデノウイルス) Human adenovirus 6 (ヒトアデノウイルス) Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4 Å | ||||||
 データ登録者 データ登録者 | Reddy, V.S. / Ma, O.X. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structure-derived insights from blood factors binding to the surfaces of different adenoviruses. 著者: Haley E Mudrick / Shao-Chia Lu / Janarjan Bhandari / Mary E Barry / Jack R Hemsath / Felix G M Andres / Olivia X Ma / Michael A Barry / Vijay S Reddy /  要旨: The tropism of adenoviruses (Ads) is significantly influenced by the binding of various blood factors. To investigate differences in their binding, we conducted cryo-EM analysis on complexes of ...The tropism of adenoviruses (Ads) is significantly influenced by the binding of various blood factors. To investigate differences in their binding, we conducted cryo-EM analysis on complexes of several human adenoviruses with human platelet factor-4 (PF4), coagulation factors FII (Prothrombin), and FX. While we observed EM densities for FII and FX bound to all the species-C adenoviruses examined, no densities were seen for PF4, even though PF4 can co-pellet with various Ads. Similar to FX, the γ-carboxyglutamic acid (Gla) domain of FII binds within the surface cavity of hexon trimers. While FII binds equally to species-C Ads: Ad5, Ad6, and Ad657, FX exhibits significantly better binding to Ad5 and Ad657 compared to Ad6. Although only the FX-Gla domain is observed at high-resolution (3.7 Å), the entire FX is visible at low-resolution bound to Ad5 in three equivalent binding modes consistent with the 3-fold symmetric hexon. Only the Gla and kringle-1 domains of FII are visible on all the species-C adenoviruses, where the rigid FII binds in an upright fashion, in contrast to the flexible and bent FX. These data suggest that differential binding of FII and FX may shield certain species-C adenoviruses differently against immune molecules, thereby modulating their tropism. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9cm9.cif.gz 9cm9.cif.gz | 558.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9cm9.ent.gz pdb9cm9.ent.gz | 453.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9cm9.json.gz 9cm9.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9cm9_validation.pdf.gz 9cm9_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9cm9_full_validation.pdf.gz 9cm9_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  9cm9_validation.xml.gz 9cm9_validation.xml.gz | 92 KB | 表示 | |
| CIF形式データ |  9cm9_validation.cif.gz 9cm9_validation.cif.gz | 137.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cm/9cm9 https://data.pdbj.org/pub/pdb/validation_reports/cm/9cm9 ftp://data.pdbj.org/pub/pdb/validation_reports/cm/9cm9 ftp://data.pdbj.org/pub/pdb/validation_reports/cm/9cm9 | HTTPS FTP |
-関連構造データ
| 関連構造データ | 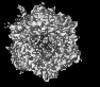 45744MC  9cliC  9clnC  9clsC  9cm2C  9cmoC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 108257.406 Da / 分子数: 3 / 由来タイプ: 天然 由来: (天然)  Human adenovirus 6 (ヒトアデノウイルス) Human adenovirus 6 (ヒトアデノウイルス)参照: UniProt: A0A348FV85 #2: タンパク質 | | 分子量: 55286.738 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q5JVE7, coagulation factor Xa Homo sapiens (ヒト) / 参照: UniProt: Q5JVE7, coagulation factor Xa#3: 化合物 | ChemComp-CA / 研究の焦点であるリガンドがあるか | Y | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| ||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: SPECIES / タイプ: VIRION | ||||||||||||||||||||||||
| 天然宿主 | 生物種: Human adenovirus 6 | ||||||||||||||||||||||||
| ウイルス殻 |
| ||||||||||||||||||||||||
| 緩衝液 | pH: 7.2 | ||||||||||||||||||||||||
| 緩衝液成分 | 濃度: 20 mM / 名称: Hepes | ||||||||||||||||||||||||
| 試料 | 濃度: 2 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 81000 X / 倍率(補正後): 81000 X / 最大 デフォーカス(公称値): 4000 nm / 最小 デフォーカス(公称値): 2500 nm / Calibrated defocus min: 1000 nm / 最大 デフォーカス(補正後): 5000 nm / Cs: 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 81 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOCONTINUUM (6k x 4k) 撮影したグリッド数: 3 / 実像数: 10000 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 59000 | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 3845 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6B1T Accession code: 6B1T / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj











