+ データを開く
データを開く
- 基本情報
基本情報
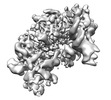
| 登録情報 | データベース: PDB / ID: 8b9d | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Human replisome bound by Pol Alpha | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | REPLICATION / human / priming / polymerase | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to bleomycin / DNA primase AEP / DNA secondary structure binding / ribonucleotide binding / detection of abiotic stimulus / regulation of nuclear cell cycle DNA replication / replication fork arrest / Switching of origins to a post-replicative state / cell cycle phase transition / Unwinding of DNA ...cellular response to bleomycin / DNA primase AEP / DNA secondary structure binding / ribonucleotide binding / detection of abiotic stimulus / regulation of nuclear cell cycle DNA replication / replication fork arrest / Switching of origins to a post-replicative state / cell cycle phase transition / Unwinding of DNA / DNA replication initiation / DNA strand elongation involved in mitotic DNA replication / GINS complex / mitotic DNA replication preinitiation complex assembly / activation of protein kinase activity / Telomere C-strand synthesis initiation / DNA/RNA hybrid binding / cellular response to cisplatin / Inhibition of replication initiation of damaged DNA by RB1/E2F1 / replication fork protection complex / nuclear origin of replication recognition complex / cellular response to hydroxyurea / regulation of type I interferon production / alpha DNA polymerase:primase complex / anaphase-promoting complex binding / Regulation of MITF-M-dependent genes involved in DNA replication, damage repair and senescence / mitotic DNA replication / Polymerase switching / CMG complex / DNA replication checkpoint signaling / regulation of phosphorylation / Processive synthesis on the lagging strand / DNA replication preinitiation complex / MCM complex / Removal of the Flap Intermediate / lagging strand elongation / mitotic DNA replication checkpoint signaling / double-strand break repair via break-induced replication / Polymerase switching on the C-strand of the telomere / mitotic DNA replication initiation / DNA replication, synthesis of primer / mitotic intra-S DNA damage checkpoint signaling / regulation of DNA-templated DNA replication initiation / inner cell mass cell proliferation / DNA strand elongation involved in DNA replication / Apoptotic cleavage of cellular proteins / branching morphogenesis of an epithelial tube / DNA synthesis involved in DNA repair / positive regulation of double-strand break repair / G1/S-Specific Transcription / leading strand elongation / mitotic G2 DNA damage checkpoint signaling / nuclear replication fork / replication fork processing / DNA replication origin binding / cochlea development / DNA replication initiation / Activation of the pre-replicative complex / Activation of ATR in response to replication stress / response to UV / positive regulation of double-strand break repair via homologous recombination / cellular response to interleukin-4 / DNA helicase activity / lung development / cellular response to epidermal growth factor stimulus / DNA damage checkpoint signaling / morphogenesis of an epithelium / Defective pyroptosis / Assembly of the pre-replicative complex / enzyme activator activity / helicase activity / circadian rhythm / regulation of circadian rhythm / peptidyl-serine phosphorylation / double-strand break repair via nonhomologous end joining / DNA-templated DNA replication / multicellular organism growth / cellular response to xenobiotic stimulus / nuclear matrix / Orc1 removal from chromatin / protein import into nucleus / DNA-directed RNA polymerase activity / cellular senescence / nuclear envelope / mitotic cell cycle / nucleosome assembly / single-stranded DNA binding / site of double-strand break / 4 iron, 4 sulfur cluster binding / Processing of DNA double-strand break ends / histone binding / DNA helicase / DNA-directed DNA polymerase / DNA-directed DNA polymerase activity / chromosome, telomeric region / DNA replication / cell population proliferation / Ub-specific processing proteases / cilium / ciliary basal body 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | ||||||
 データ登録者 データ登録者 | Jones, M.L. / Yeeles, J.T.P. | ||||||
| 資金援助 |  英国, 1件 英国, 1件
| ||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2023 ジャーナル: Mol Cell / 年: 2023タイトル: How Pol α-primase is targeted to replisomes to prime eukaryotic DNA replication. 著者: Morgan L Jones / Valentina Aria / Yasemin Baris / Joseph T P Yeeles /  要旨: During eukaryotic DNA replication, Pol α-primase generates primers at replication origins to start leading-strand synthesis and every few hundred nucleotides during discontinuous lagging-strand ...During eukaryotic DNA replication, Pol α-primase generates primers at replication origins to start leading-strand synthesis and every few hundred nucleotides during discontinuous lagging-strand replication. How Pol α-primase is targeted to replication forks to prime DNA synthesis is not fully understood. Here, by determining cryoelectron microscopy (cryo-EM) structures of budding yeast and human replisomes containing Pol α-primase, we reveal a conserved mechanism for the coordination of priming by the replisome. Pol α-primase binds directly to the leading edge of the CMG (CDC45-MCM-GINS) replicative helicase via a complex interaction network. The non-catalytic PRIM2/Pri2 subunit forms two interfaces with CMG that are critical for in vitro DNA replication and yeast cell growth. These interactions position the primase catalytic subunit PRIM1/Pri1 directly above the exit channel for lagging-strand template single-stranded DNA (ssDNA), revealing why priming occurs efficiently only on the lagging-strand template and elucidating a mechanism for Pol α-primase to overcome competition from RPA to initiate primer synthesis. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8b9d.cif.gz 8b9d.cif.gz | 2.8 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8b9d.ent.gz pdb8b9d.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8b9d.json.gz 8b9d.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8b9d_validation.pdf.gz 8b9d_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8b9d_full_validation.pdf.gz 8b9d_full_validation.pdf.gz | 1.6 MB | 表示 | |
| XML形式データ |  8b9d_validation.xml.gz 8b9d_validation.xml.gz | 184.5 KB | 表示 | |
| CIF形式データ |  8b9d_validation.cif.gz 8b9d_validation.cif.gz | 304.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/b9/8b9d https://data.pdbj.org/pub/pdb/validation_reports/b9/8b9d ftp://data.pdbj.org/pub/pdb/validation_reports/b9/8b9d ftp://data.pdbj.org/pub/pdb/validation_reports/b9/8b9d | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-DNA replication licensing factor ... , 6種, 6分子 234567
| #1: タンパク質 | 分子量: 102034.102 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MCM2, BM28, CCNL1, CDCL1, KIAA0030 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MCM2, BM28, CCNL1, CDCL1, KIAA0030 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49736, DNA helicase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49736, DNA helicase |
|---|---|
| #2: タンパク質 | 分子量: 91110.852 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MCM3 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MCM3 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P25205, DNA helicase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P25205, DNA helicase |
| #3: タンパク質 | 分子量: 96684.852 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MCM4, CDC21 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MCM4, CDC21 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P33991, DNA helicase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P33991, DNA helicase |
| #4: タンパク質 | 分子量: 82406.633 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MCM5, CDC46 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MCM5, CDC46 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P33992, DNA helicase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P33992, DNA helicase |
| #5: タンパク質 | 分子量: 93010.273 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MCM6 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MCM6 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q14566, DNA helicase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q14566, DNA helicase |
| #6: タンパク質 | 分子量: 81411.875 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MCM7, CDC47, MCM2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MCM7, CDC47, MCM2 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P33993, DNA helicase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P33993, DNA helicase |
-DNA polymerase alpha ... , 2種, 2分子 AB
| #7: タンパク質 | 分子量: 66015.539 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: POLA2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: POLA2 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q14181 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q14181 |
|---|---|
| #21: タンパク質 | 分子量: 170392.656 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: POLA1, POLA / 発現宿主: Homo sapiens (ヒト) / 遺伝子: POLA1, POLA / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P09884, DNA-directed DNA polymerase Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P09884, DNA-directed DNA polymerase |
-タンパク質 , 7種, 9分子 CKLPQOHJI
| #8: タンパク質 | 分子量: 66016.891 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CDC45, CDC45L, CDC45L2, UNQ374/PRO710 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CDC45, CDC45L, CDC45L2, UNQ374/PRO710 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: O75419 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: O75419 |
|---|---|
| #13: タンパク質 | 分子量: 138903.031 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: TIMELESS, TIM, TIM1, TIMELESS1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TIMELESS, TIM, TIM1, TIMELESS1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9UNS1 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9UNS1 |
| #14: タンパク質 | 分子量: 34600.223 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: TIPIN / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TIPIN / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BVW5 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BVW5 |
| #17: タンパク質 | 分子量: 58890.918 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRIM2, PRIM2A / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PRIM2, PRIM2A / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49643 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49643 |
| #18: タンパク質 | 分子量: 155184.703 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CLSPN / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CLSPN / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9HAW4 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9HAW4 |
| #19: タンパク質 | 分子量: 54242.598 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRIM1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PRIM1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49642, DNA primase AEP Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49642, DNA primase AEP |
| #20: タンパク質 | 分子量: 129966.961 Da / 分子数: 3 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: WDHD1, AND1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: WDHD1, AND1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: O75717 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: O75717 |
-DNA replication complex GINS protein ... , 4種, 4分子 DEFG
| #9: タンパク質 | 分子量: 23022.469 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GINS1, KIAA0186, PSF1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GINS1, KIAA0186, PSF1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q14691 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q14691 |
|---|---|
| #10: タンパク質 | 分子量: 21453.713 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GINS2, PSF2, CGI-122, DC5, HSPC037 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GINS2, PSF2, CGI-122, DC5, HSPC037 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9Y248 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9Y248 |
| #11: タンパク質 | 分子量: 24562.611 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GINS3, PSF3 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GINS3, PSF3 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BRX5 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BRX5 |
| #12: タンパク質 | 分子量: 29983.041 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GINS4, SLD5 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GINS4, SLD5 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BRT9 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BRT9 |
-DNA鎖 , 2種, 2分子 MN
| #15: DNA鎖 | 分子量: 26092.645 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|---|
| #16: DNA鎖 | 分子量: 26402.895 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-非ポリマー , 3種, 10分子 




| #22: 化合物 | | #23: 化合物 | #24: 化合物 | ChemComp-ZN / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Human replisome bound by pol alpha, engaged on a fork DNA substrate with a 60 nucleotide lagging strand. タイプ: COMPLEX Entity ID: #19, #7, #21, #17, #1-#6, #8-#12, #20, #13-#16, #18 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 緩衝液 | pH: 7.6 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 37.8 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| EMソフトウェア | 名称: PHENIX / バージョン: 1.20_4459: / カテゴリ: モデル精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 174696 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





























 PDBj
PDBj
























































