+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7rnu | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | nSH2 domain of p85-beta subunit of phosphatidylinositol 3-kinase in complex with an actin peptide with phosphorylated tyrosine 53 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | PEPTIDE BINDING PROTEIN / phosphorylated tyrosine binding protein / actin peptide | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of actin filament polymerization / 1-phosphatidylinositol-3-kinase regulator activity / IRS-mediated signalling / Formation of the dystrophin-glycoprotein complex (DGC) / phosphatidylinositol 3-kinase regulatory subunit binding / regulation of stress fiber assembly / Co-stimulation by ICOS / RHOD GTPase cycle / Striated Muscle Contraction / RHOF GTPase cycle ...regulation of actin filament polymerization / 1-phosphatidylinositol-3-kinase regulator activity / IRS-mediated signalling / Formation of the dystrophin-glycoprotein complex (DGC) / phosphatidylinositol 3-kinase regulatory subunit binding / regulation of stress fiber assembly / Co-stimulation by ICOS / RHOD GTPase cycle / Striated Muscle Contraction / RHOF GTPase cycle / phosphatidylinositol 3-kinase complex, class IA / Nephrin family interactions / Signaling by LTK in cancer / Signaling by LTK / PI3K/AKT activation / RND1 GTPase cycle / RND2 GTPase cycle / RND3 GTPase cycle / Signaling by ALK / RHOB GTPase cycle / myosin binding / RHOJ GTPase cycle / intracellular glucose homeostasis / mesenchyme migration / Synthesis of PIPs at the plasma membrane / RHOU GTPase cycle / CDC42 GTPase cycle / RET signaling / striated muscle thin filament / Interleukin-3, Interleukin-5 and GM-CSF signaling / skeletal muscle thin filament assembly / PI3K Cascade / T cell differentiation / RHOA GTPase cycle / CD28 dependent PI3K/Akt signaling / Role of LAT2/NTAL/LAB on calcium mobilization / RAC2 GTPase cycle / RAC3 GTPase cycle / Interleukin receptor SHC signaling / Role of phospholipids in phagocytosis / regulation of protein localization to plasma membrane / Signaling by PDGFRA transmembrane, juxtamembrane and kinase domain mutants / Signaling by PDGFRA extracellular domain mutants / negative regulation of MAPK cascade / skeletal muscle fiber development / stress fiber / GPVI-mediated activation cascade / Tie2 Signaling / phosphotyrosine residue binding / RAC1 GTPase cycle / Downstream signal transduction / Interleukin-7 signaling / positive regulation of cell adhesion / muscle contraction / Regulation of signaling by CBL / Signaling by phosphorylated juxtamembrane, extracellular and kinase domain KIT mutants / response to endoplasmic reticulum stress / sarcomere / B cell differentiation / actin filament / filopodium / phosphatidylinositol 3-kinase/protein kinase B signal transduction / Signaling by SCF-KIT / ADP binding / receptor tyrosine kinase binding / structural constituent of cytoskeleton / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / positive regulation of protein import into nucleus / VEGFA-VEGFR2 Pathway / cellular response to insulin stimulus / Signaling by ALK fusions and activated point mutants / Constitutive Signaling by Aberrant PI3K in Cancer / Downstream TCR signaling / insulin receptor signaling pathway / DAP12 signaling / protein transport / PIP3 activates AKT signaling / actin cytoskeleton / lamellipodium / cell body / RAF/MAP kinase cascade / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / High laminar flow shear stress activates signaling by PIEZO1 and PECAM1:CDH5:KDR in endothelial cells / blood microparticle / protein phosphatase binding / G alpha (q) signalling events / Extra-nuclear estrogen signaling / hydrolase activity / regulation of autophagy / immune response / protein heterodimerization activity / focal adhesion / positive regulation of gene expression / positive regulation of transcription by RNA polymerase II / extracellular space / extracellular exosome / ATP binding / nucleus / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.45 Å 分子置換 / 解像度: 1.45 Å | ||||||
 データ登録者 データ登録者 | Dai, S. / Horton, J.R. / Cheng, X. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: The Functional Analysis of a Major Tyrosine Phosphorylation Site on Actin 著者: Amelie, A. / Dai, S. / Shen, X. / Horton, J.R. / Zhang, X. / Cheng, X. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7rnu.cif.gz 7rnu.cif.gz | 141.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7rnu.ent.gz pdb7rnu.ent.gz | 89.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7rnu.json.gz 7rnu.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7rnu_validation.pdf.gz 7rnu_validation.pdf.gz | 494.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7rnu_full_validation.pdf.gz 7rnu_full_validation.pdf.gz | 497.5 KB | 表示 | |
| XML形式データ |  7rnu_validation.xml.gz 7rnu_validation.xml.gz | 24.5 KB | 表示 | |
| CIF形式データ |  7rnu_validation.cif.gz 7rnu_validation.cif.gz | 34.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/rn/7rnu https://data.pdbj.org/pub/pdb/validation_reports/rn/7rnu ftp://data.pdbj.org/pub/pdb/validation_reports/rn/7rnu ftp://data.pdbj.org/pub/pdb/validation_reports/rn/7rnu | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 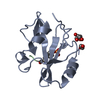
| ||||||||||||
| 2 | 
| ||||||||||||
| 3 | 
| ||||||||||||
| 4 | 
| ||||||||||||
| 単位格子 |
| ||||||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 13029.506 Da / 分子数: 4 / 断片: nSH2 domain (UNP residues 318-428) / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PIK3R2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PIK3R2 / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 1063.975 Da / 分子数: 4 / 断片: UNP residues 52-60 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) / 参照: UniProt: P68133 Homo sapiens (ヒト) / 参照: UniProt: P68133#3: 化合物 | ChemComp-EDO / #4: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.33 Å3/Da / 溶媒含有率: 47.27 % |
|---|---|
| 結晶化 | 温度: 292 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 5 / 詳細: 25% w/v PEG1500, 100 mM MIB, pH 5.0 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 22-ID / 波長: 1 Å / ビームライン: 22-ID / 波長: 1 Å |
| 検出器 | タイプ: DECTRIS EIGER X 16M / 検出器: PIXEL / 日付: 2020年9月28日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 1.45→34.92 Å / Num. obs: 79846 / % possible obs: 89.7 % / 冗長度: 4.5 % / Biso Wilson estimate: 15.07 Å2 / CC1/2: 0.991 / Net I/σ(I): 11.8 |
| 反射 シェル | 解像度: 1.45→1.5 Å / Num. unique obs: 4489 / CC1/2: 0.69 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB entry 2IUI 解像度: 1.45→34.92 Å / SU ML: 0.1734 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 25.4433 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 23.19 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.45→34.92 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj