+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6umh | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of erenumab Fab-a | ||||||
 Components Components | (erenumab Fab ...) x 2 | ||||||
 Keywords Keywords | IMMUNE SYSTEM / Fragment antigen binding | ||||||
| Function / homology | Immunoglobulins / Immunoglobulin-like / Sandwich / Mainly Beta / 1,3-PROPANDIOL / PHOSPHATE ION Function and homology information Function and homology information | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / Resolution: 2.15 Å MOLECULAR REPLACEMENT / Resolution: 2.15 Å | ||||||
 Authors Authors | Mohr, C. | ||||||
 Citation Citation |  Journal: Cell Rep / Year: 2020 Journal: Cell Rep / Year: 2020Title: Molecular Insight into Recognition of the CGRPR Complex by Migraine Prevention Therapy Aimovig (Erenumab). Authors: Garces, F. / Mohr, C. / Zhang, L. / Huang, C.S. / Chen, Q. / King, C. / Xu, C. / Wang, Z. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6umh.cif.gz 6umh.cif.gz | 350 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6umh.ent.gz pdb6umh.ent.gz | 286.7 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6umh.json.gz 6umh.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  6umh_validation.pdf.gz 6umh_validation.pdf.gz | 466 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  6umh_full_validation.pdf.gz 6umh_full_validation.pdf.gz | 469.7 KB | Display | |
| Data in XML |  6umh_validation.xml.gz 6umh_validation.xml.gz | 33.8 KB | Display | |
| Data in CIF |  6umh_validation.cif.gz 6umh_validation.cif.gz | 48 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/um/6umh https://data.pdbj.org/pub/pdb/validation_reports/um/6umh ftp://data.pdbj.org/pub/pdb/validation_reports/um/6umh ftp://data.pdbj.org/pub/pdb/validation_reports/um/6umh | HTTPS FTP |
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
|
- Components
Components
-Antibody , 2 types, 4 molecules HhLl
| #1: Antibody | Mass: 25483.525 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Plasmid: pTT5 / Cell line (production host): HEK 293-6E / Production host: Homo sapiens (human) / Plasmid: pTT5 / Cell line (production host): HEK 293-6E / Production host:  Homo sapiens (human) Homo sapiens (human)#2: Antibody | Mass: 22827.324 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Plasmid: pTT5 / Cell line (production host): HEK 293-6E / Production host: Homo sapiens (human) / Plasmid: pTT5 / Cell line (production host): HEK 293-6E / Production host:  Homo sapiens (human) Homo sapiens (human) |
|---|
-Non-polymers , 4 types, 294 molecules 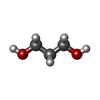






| #3: Chemical | ChemComp-PDO / #4: Chemical | ChemComp-PO4 / #5: Chemical | #6: Water | ChemComp-HOH / | |
|---|
-Details
| Has ligand of interest | N |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.86 Å3/Da / Density % sol: 56.93 % |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop / pH: 8.5 Details: 0.2 M ammonium dihydrogen phosphate, 0.1 M Tris, pH 8.5, 50% MPD, 4% 1,3-propanediol |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU FR-E SUPERBRIGHT / Wavelength: 1.5418 Å ROTATING ANODE / Type: RIGAKU FR-E SUPERBRIGHT / Wavelength: 1.5418 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: RIGAKU SATURN 92 / Detector: CCD / Date: Aug 6, 2014 / Details: VariMax HF | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.15→30 Å / Num. obs: 58318 / % possible obs: 97.8 % / Redundancy: 6.9 % / Rmerge(I) obs: 0.068 / Rpim(I) all: 0.027 / Rrim(I) all: 0.073 / Χ2: 1 / Net I/σ(I): 11.2 / Num. measured all: 400151 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Χ2: 1 / Diffraction-ID: 1
|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT / Resolution: 2.15→30 Å / Cor.coef. Fo:Fc: 0.962 / Cor.coef. Fo:Fc free: 0.945 / SU B: 11.299 / SU ML: 0.144 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.208 / ESU R Free: 0.176 MOLECULAR REPLACEMENT / Resolution: 2.15→30 Å / Cor.coef. Fo:Fc: 0.962 / Cor.coef. Fo:Fc free: 0.945 / SU B: 11.299 / SU ML: 0.144 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.208 / ESU R Free: 0.176 Details: U VALUES : WITH TLS ADDED HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 106.59 Å2 / Biso mean: 46.151 Å2 / Biso min: 13.96 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 2.15→30 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.152→2.207 Å / Rfactor Rfree error: 0 / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller
















 PDBj
PDBj




