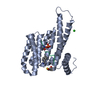
Entry Database : PDB / ID : 6qhmTitle 14-3-3 sigma with RelA/p65 binding site pS281 14-3-3 protein sigma LEU-SEP-GLU Keywords / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species Homo sapiens (human)Method / / / Resolution : 1.25 Å Authors Wolter, M. / Ottmann, C. Funding support Organization Grant number Country European Commission H2020 Marie Curie Actions, Grant Agreement 675179
Journal : J.Am.Chem.Soc. / Year : 2020Title : Selectivity via Cooperativity: Preferential Stabilization of the p65/14-3-3 Interaction with Semisynthetic Natural Products.Authors : Wolter, M. / de Vink, P. / Neves, J.F. / Srdanovic, S. / Higuchi, Y. / Kato, N. / Wilson, A. / Landrieu, I. / Brunsveld, L. / Ottmann, C. History Deposition Jan 16, 2019 Deposition site / Processing site Revision 1.0 May 13, 2020 Provider / Type Revision 1.1 Jun 24, 2020 Group / Category / citation_authorItem _citation.country / _citation.journal_abbrev ... _citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.title / _citation.year Revision 1.2 Jul 1, 2020 Group / Category / Item / _citation.titleRevision 1.3 Jul 15, 2020 Group / Category / citation_authorItem _citation.journal_volume / _citation.page_first ... _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.title / _citation_author.name Revision 1.4 Jan 24, 2024 Group / Database references / Refinement descriptionCategory chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_database_accessionRevision 1.5 Oct 23, 2024 Group / Category / pdbx_modification_feature
Show all Show less
 Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information Homo sapiens (human)
Homo sapiens (human) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.25 Å
MOLECULAR REPLACEMENT / Resolution: 1.25 Å  Authors
Authors Netherlands, 1items
Netherlands, 1items  Citation
Citation Journal: J.Am.Chem.Soc. / Year: 2020
Journal: J.Am.Chem.Soc. / Year: 2020 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 6qhm.cif.gz
6qhm.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb6qhm.ent.gz
pdb6qhm.ent.gz PDB format
PDB format 6qhm.json.gz
6qhm.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/qh/6qhm
https://data.pdbj.org/pub/pdb/validation_reports/qh/6qhm ftp://data.pdbj.org/pub/pdb/validation_reports/qh/6qhm
ftp://data.pdbj.org/pub/pdb/validation_reports/qh/6qhm


 Links
Links Assembly
Assembly

 Components
Components Homo sapiens (human) / Gene: SFN, HME1 / Production host:
Homo sapiens (human) / Gene: SFN, HME1 / Production host: 
 Homo sapiens (human) / References: UniProt: Q04206*PLUS
Homo sapiens (human) / References: UniProt: Q04206*PLUS X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  PETRA III, DESY
PETRA III, DESY  / Beamline: P11 / Wavelength: 1.03322 Å
/ Beamline: P11 / Wavelength: 1.03322 Å Processing
Processing MOLECULAR REPLACEMENT
MOLECULAR REPLACEMENT Movie
Movie Controller
Controller






















 PDBj
PDBj

























