+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6kyh | ||||||
|---|---|---|---|---|---|---|---|
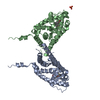
| タイトル | Crystal structure of Shank3 NTD-ANK A42K mutant in complex with HRas | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | STRUCTURAL PROTEIN/SIGNALING PROTEIN / Shank3 / GTPase / synaptic scaffold protein / STRUCTURAL PROTEIN-SIGNALING PROTEIN complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Activation of RAS in B cells / Estrogen-stimulated signaling through PRKCZ / SHC1 events in ERBB4 signaling / GRB2 events in ERBB2 signaling / EGFR Transactivation by Gastrin / SHC-mediated cascade:FGFR3 / SHC-mediated cascade:FGFR4 / SHC-mediated cascade:FGFR1 / SHC-mediated cascade:FGFR2 / VEGFR2 mediated cell proliferation ...Activation of RAS in B cells / Estrogen-stimulated signaling through PRKCZ / SHC1 events in ERBB4 signaling / GRB2 events in ERBB2 signaling / EGFR Transactivation by Gastrin / SHC-mediated cascade:FGFR3 / SHC-mediated cascade:FGFR4 / SHC-mediated cascade:FGFR1 / SHC-mediated cascade:FGFR2 / VEGFR2 mediated cell proliferation / FRS-mediated FGFR3 signaling / FRS-mediated FGFR4 signaling / MET activates RAS signaling / response to interleukin-17 / FRS-mediated FGFR1 signaling / FRS-mediated FGFR2 signaling / Tie2 Signaling / GRB2 events in EGFR signaling / SHC1 events in EGFR signaling / FLT3 Signaling / PTK6 Regulates RHO GTPases, RAS GTPase and MAP kinases / regulation of AMPA glutamate receptor clustering / NCAM signaling for neurite out-growth / Neurexins and neuroligins / guanylate kinase-associated protein clustering / positive regulation of synapse structural plasticity / striatal medium spiny neuron differentiation / Downstream signal transduction / synaptic receptor adaptor activity / Negative regulation of MAPK pathway / EPHB-mediated forward signaling / FCERI mediated MAPK activation / Signaling by SCF-KIT / postsynaptic density assembly / Regulation of RAS by GAPs / embryonic epithelial tube formation / RAF activation / RAS processing / MAP2K and MAPK activation / regulation of grooming behavior / RAF/MAP kinase cascade / structural constituent of postsynaptic density / negative regulation of actin filament bundle assembly / p38MAPK events / positive regulation of long-term neuronal synaptic plasticity / NMDA glutamate receptor clustering / negative regulation of cell volume / CD209 (DC-SIGN) signaling / RET signaling / vocalization behavior / neuron spine / AMPA glutamate receptor clustering / positive regulation of glutamate receptor signaling pathway / regulation of behavioral fear response / regulation of dendritic spine morphogenesis / dendritic spine morphogenesis / GTPase complex / brain morphogenesis / locomotion / oncogene-induced cell senescence / regulation of long-term synaptic potentiation / positive regulation of Ras protein signal transduction / long-term synaptic depression / DAP12 signaling / positive regulation of miRNA metabolic process / positive regulation of ruffle assembly / neural precursor cell proliferation / T-helper 1 type immune response / ciliary membrane / neuromuscular process controlling balance / small GTPase-mediated signal transduction / positive regulation of wound healing / defense response to protozoan / ERBB2-ERBB3 signaling pathway / positive regulation of dendritic spine development / regulation of neurotransmitter receptor localization to postsynaptic specialization membrane / exploration behavior / locomotory exploration behavior / associative learning / excitatory synapse / social behavior / positive regulation of protein targeting to membrane / positive regulation of excitatory postsynaptic potential / adipose tissue development / positive regulation of synaptic transmission, glutamatergic / Schwann cell development / glial cell proliferation / synapse assembly / regulation of long-term synaptic depression / protein-membrane adaptor activity / myelination / ionotropic glutamate receptor binding / intrinsic apoptotic signaling pathway / insulin-like growth factor receptor signaling pathway / positive regulation of DNA replication / positive regulation of long-term synaptic potentiation / positive regulation of epithelial cell proliferation / small monomeric GTPase / learning / regulation of actin cytoskeleton organization 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3.3 Å 分子置換 / 解像度: 3.3 Å | ||||||
 データ登録者 データ登録者 | Cai, Q. / Zhang, M. | ||||||
| 資金援助 |  香港, 1件 香港, 1件
| ||||||
 引用 引用 |  ジャーナル: Structure / 年: 2020 ジャーナル: Structure / 年: 2020タイトル: Shank3 Binds to and Stabilizes the Active Form of Rap1 and HRas GTPases via Its NTD-ANK Tandem with Distinct Mechanisms. 著者: Cai, Q. / Hosokawa, T. / Zeng, M. / Hayashi, Y. / Zhang, M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6kyh.cif.gz 6kyh.cif.gz | 410.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6kyh.ent.gz pdb6kyh.ent.gz | 333.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6kyh.json.gz 6kyh.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6kyh_validation.pdf.gz 6kyh_validation.pdf.gz | 2.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6kyh_full_validation.pdf.gz 6kyh_full_validation.pdf.gz | 2.5 MB | 表示 | |
| XML形式データ |  6kyh_validation.xml.gz 6kyh_validation.xml.gz | 77.5 KB | 表示 | |
| CIF形式データ |  6kyh_validation.cif.gz 6kyh_validation.cif.gz | 103.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ky/6kyh https://data.pdbj.org/pub/pdb/validation_reports/ky/6kyh ftp://data.pdbj.org/pub/pdb/validation_reports/ky/6kyh ftp://data.pdbj.org/pub/pdb/validation_reports/ky/6kyh | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 単位格子 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Component-ID: _ / Refine code: _
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj











