+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5mey | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of Smad4-MH1 bound to the GGCGC site. | ||||||
 Components Components |
| ||||||
 Keywords Keywords | TRANSCRIPTION / Smads / transcription factor / DNA complex | ||||||
| Function / homology |  Function and homology information Function and homology information: / female gonad morphogenesis / negative regulation of cardiac myofibril assembly / metanephric mesenchyme morphogenesis / nephrogenic mesenchyme morphogenesis / somite rostral/caudal axis specification / activin responsive factor complex / atrioventricular valve formation / SMAD4 MH2 Domain Mutants in Cancer / SMAD2/3 MH2 Domain Mutants in Cancer ...: / female gonad morphogenesis / negative regulation of cardiac myofibril assembly / metanephric mesenchyme morphogenesis / nephrogenic mesenchyme morphogenesis / somite rostral/caudal axis specification / activin responsive factor complex / atrioventricular valve formation / SMAD4 MH2 Domain Mutants in Cancer / SMAD2/3 MH2 Domain Mutants in Cancer / mesendoderm development / regulation of hair follicle development / sebaceous gland development / SMAD protein complex / positive regulation of luteinizing hormone secretion / filamin binding / formation of anatomical boundary / RUNX2 regulates bone development / heteromeric SMAD protein complex / epithelial cell migration / regulation of transforming growth factor beta2 production / positive regulation of follicle-stimulating hormone secretion / RUNX3 regulates BCL2L11 (BIM) transcription / endocardial cell differentiation / epithelial to mesenchymal transition involved in endocardial cushion formation / FOXO-mediated transcription of cell cycle genes / response to transforming growth factor beta / neuron fate specification / secondary palate development / brainstem development / left ventricular cardiac muscle tissue morphogenesis / positive regulation of extracellular matrix assembly / negative regulation of cardiac muscle hypertrophy / Transcriptional regulation of pluripotent stem cells / atrioventricular canal development / cardiac conduction system development / sulfate binding / Germ layer formation at gastrulation / cellular response to BMP stimulus / SMAD protein signal transduction / Signaling by BMP / Formation of definitive endoderm / Signaling by Activin / activin receptor signaling pathway / Signaling by NODAL / outflow tract septum morphogenesis / gastrulation with mouth forming second / I-SMAD binding / cardiac muscle hypertrophy in response to stress / TGFBR3 expression / Cardiogenesis / RUNX3 regulates CDKN1A transcription / endothelial cell activation / adrenal gland development / embryonic digit morphogenesis / neural crest cell differentiation / branching involved in ureteric bud morphogenesis / interleukin-6-mediated signaling pathway / ventricular septum morphogenesis / seminiferous tubule development / positive regulation of transforming growth factor beta receptor signaling pathway / uterus development / R-SMAD binding / TGF-beta receptor signaling activates SMADs / positive regulation of SMAD protein signal transduction / epithelial to mesenchymal transition / developmental growth / anatomical structure morphogenesis / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / BMP signaling pathway / single fertilization / cellular response to transforming growth factor beta stimulus / positive regulation of epithelial to mesenchymal transition / positive regulation of cardiac muscle cell apoptotic process / Transcriptional regulation of brown and beige adipocyte differentiation by EBF2 / ovarian follicle development / collagen binding / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / extrinsic apoptotic signaling pathway / ERK1 and ERK2 cascade / transforming growth factor beta receptor signaling pathway / axon guidance / transcription corepressor binding / Downregulation of SMAD2/3:SMAD4 transcriptional activity / cellular response to glucose stimulus / SMAD2/SMAD3:SMAD4 heterotrimer regulates transcription / negative regulation of canonical Wnt signaling pathway / negative regulation of cell growth / negative regulation of protein catabolic process / negative regulation of ERK1 and ERK2 cascade / positive regulation of miRNA transcription / transcription coactivator binding / osteoblast differentiation / DNA-binding transcription activator activity, RNA polymerase II-specific / spermatogenesis / transcription regulator complex / sequence-specific DNA binding / in utero embryonic development / RNA polymerase II-specific DNA-binding transcription factor binding / intracellular iron ion homeostasis Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.05 Å MOLECULAR REPLACEMENT / Resolution: 2.05 Å | ||||||
 Authors Authors | Kaczmarska, Z. / Freier, R. / Marquez, J.A. / Macias, M.J. | ||||||
 Citation Citation |  Journal: Nat Commun / Year: 2017 Journal: Nat Commun / Year: 2017Title: Structural basis for genome wide recognition of 5-bp GC motifs by SMAD transcription factors. Authors: Martin-Malpartida, P. / Batet, M. / Kaczmarska, Z. / Freier, R. / Gomes, T. / Aragon, E. / Zou, Y. / Wang, Q. / Xi, Q. / Ruiz, L. / Vea, A. / Marquez, J.A. / Massague, J. / Macias, M.J. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5mey.cif.gz 5mey.cif.gz | 70.8 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5mey.ent.gz pdb5mey.ent.gz | 45.7 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5mey.json.gz 5mey.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/me/5mey https://data.pdbj.org/pub/pdb/validation_reports/me/5mey ftp://data.pdbj.org/pub/pdb/validation_reports/me/5mey ftp://data.pdbj.org/pub/pdb/validation_reports/me/5mey | HTTPS FTP |
|---|
-Related structure data
| Related structure data | 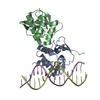 5mezC  5mf0C  5nm9C  5od6C  5odgC  3qsvS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| Unit cell |
|
- Components
Components
-Protein / DNA chain , 2 types, 2 molecules AD
| #1: Protein | Mass: 15237.578 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: SMAD4, DPC4, MADH4 / Production host: Homo sapiens (human) / Gene: SMAD4, DPC4, MADH4 / Production host:  |
|---|---|
| #2: DNA chain | Mass: 5518.555 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.)  Homo sapiens (human) Homo sapiens (human) |
-Non-polymers , 6 types, 105 molecules 










| #3: Chemical | ChemComp-ZN / | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| #4: Chemical | ChemComp-CL / #5: Chemical | #6: Chemical | ChemComp-EDO / | #7: Chemical | ChemComp-CA / #8: Water | ChemComp-HOH / | |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.75 Å3/Da / Density % sol: 55.28 % |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop Details: 17% PEG 6000, 0.2 M NaCl, 0.1 M sodium acetate pH 5.0 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  ESRF ESRF  / Beamline: ID23-2 / Wavelength: 0.9763 Å / Beamline: ID23-2 / Wavelength: 0.9763 Å |
| Detector | Type: DECTRIS PILATUS 2M / Detector: PIXEL / Date: Sep 23, 2016 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9763 Å / Relative weight: 1 |
| Reflection | Resolution: 2.05→50 Å / Num. obs: 14710 / % possible obs: 99.9 % / Redundancy: 6.2 % / Biso Wilson estimate: 45.27 Å2 / Rrim(I) all: 0.067 / Net I/σ(I): 17.72 |
| Reflection shell | Resolution: 2.05→2.06 Å / Redundancy: 6 % / Mean I/σ(I) obs: 1.59 / Num. measured obs: 1329 / Num. unique all: 221 / CC1/2: 0.653 / Rrim(I) all: 1.183 / % possible all: 100 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 3qsv Resolution: 2.05→29.7 Å / Cor.coef. Fo:Fc: 0.937 / Cor.coef. Fo:Fc free: 0.945 / Rfactor Rfree error: 0 / SU R Cruickshank DPI: 0.183 / Cross valid method: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.196 / SU Rfree Blow DPI: 0.158 / SU Rfree Cruickshank DPI: 0.152
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 49.65 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.34 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: 1 / Resolution: 2.05→29.7 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.05→2.21 Å / Rfactor Rfree error: 0 / Total num. of bins used: 7
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Origin x: -15.9256 Å / Origin y: -16.9063 Å / Origin z: 3.2349 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group | Selection details: { A|* } |
 Movie
Movie Controller
Controller













 PDBj
PDBj
























































