[English] 日本語
 Yorodumi
Yorodumi- PDB-5k8v: Crystal Structure of Mus musculus Protein Arginine Methyltransfer... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5k8v | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of Mus musculus Protein Arginine Methyltransferase 4 (CARM1 130-487) with CP1 | |||||||||
 Components Components | Histone-arginine methyltransferase CARM1 | |||||||||
 Keywords Keywords | TRANSFERASE / PROTEIN ARGININE METHYLTRANSFERASE / CATALYTIC DOMAIN / CHROMATIN REGULATOR / MRNA PROCESSING / MRNA SPLICING / NUCLEUS / S-ADENOSYL-L-METHIONINE / TRANSCRIPTION / TRANSCRIPTION REGULATION | |||||||||
| Function / homology |  Function and homology information Function and homology informationregulation of growth plate cartilage chondrocyte proliferation / histone H3R26 methyltransferase activity / histone H3R17 methyltransferase activity / endochondral bone morphogenesis / histone H3R2 methyltransferase activity / RMTs methylate histone arginines / Regulation of lipid metabolism by PPARalpha / Cytoprotection by HMOX1 / protein-arginine omega-N asymmetric methyltransferase activity / type I protein arginine methyltransferase ...regulation of growth plate cartilage chondrocyte proliferation / histone H3R26 methyltransferase activity / histone H3R17 methyltransferase activity / endochondral bone morphogenesis / histone H3R2 methyltransferase activity / RMTs methylate histone arginines / Regulation of lipid metabolism by PPARalpha / Cytoprotection by HMOX1 / protein-arginine omega-N asymmetric methyltransferase activity / type I protein arginine methyltransferase / Estrogen-dependent gene expression / protein methyltransferase activity / regulation of intracellular estrogen receptor signaling pathway / replication fork reversal / protein-arginine N-methyltransferase activity / histone methyltransferase activity / nuclear replication fork / nuclear receptor-mediated steroid hormone signaling pathway / positive regulation of fat cell differentiation / estrogen receptor signaling pathway / protein localization to chromatin / RNA polymerase II transcription regulator complex / methylation / transcription coactivator activity / cell population proliferation / transcription cis-regulatory region binding / positive regulation of cell population proliferation / regulation of DNA-templated transcription / positive regulation of transcription by RNA polymerase II / protein-containing complex / nucleus / cytosol Similarity search - Function | |||||||||
| Biological species |  | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.25 Å MOLECULAR REPLACEMENT / Resolution: 2.25 Å | |||||||||
 Authors Authors | Cura, V. / Marechal, N. / Mailliot, J. / Troffer-Charlier, N. / Hassenboehler, P. / Wurtz, J.M. / Bonnefond, L. / Cavarelli, J. | |||||||||
 Citation Citation |  Journal: FEBS J. / Year: 2017 Journal: FEBS J. / Year: 2017Title: Structural studies of protein arginine methyltransferase 2 reveal its interactions with potential substrates and inhibitors. Authors: Cura, V. / Marechal, N. / Troffer-Charlier, N. / Strub, J.M. / van Haren, M.J. / Martin, N.I. / Cianferani, S. / Bonnefond, L. / Cavarelli, J. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5k8v.cif.gz 5k8v.cif.gz | 799.1 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5k8v.ent.gz pdb5k8v.ent.gz | 681.7 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5k8v.json.gz 5k8v.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/k8/5k8v https://data.pdbj.org/pub/pdb/validation_reports/k8/5k8v ftp://data.pdbj.org/pub/pdb/validation_reports/k8/5k8v ftp://data.pdbj.org/pub/pdb/validation_reports/k8/5k8v | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5fubC  5fulC  5fwaC  5fwdC  5g02C  5jmqC  5ih3S S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||||
| Unit cell |
| ||||||||||||
| Components on special symmetry positions |
|
- Components
Components
-Protein , 1 types, 4 molecules ABCD
| #1: Protein | Mass: 40850.457 Da / Num. of mol.: 4 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   References: UniProt: Q9WVG6, type I protein arginine methyltransferase |
|---|
-Non-polymers , 6 types, 614 molecules 



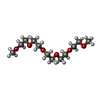






| #2: Chemical | ChemComp-6RE / [[ #3: Chemical | ChemComp-DXE / | #4: Chemical | ChemComp-EDO / #5: Chemical | #6: Chemical | ChemComp-PG6 / | #7: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.32 Å3/Da / Density % sol: 47.08 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 8 Details: Tris-HCl pH 8.0 100 mM, PEG 2000 MME 15 %, NaCl 100 mM |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SOLEIL SOLEIL  / Beamline: PROXIMA 2 / Wavelength: 0.9801 Å / Beamline: PROXIMA 2 / Wavelength: 0.9801 Å |
| Detector | Type: ADSC QUANTUM 315r / Detector: CCD / Date: Mar 26, 2015 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9801 Å / Relative weight: 1 |
| Reflection | Resolution: 2.25→47.72 Å / Num. obs: 73068 / % possible obs: 99.8 % / Redundancy: 6.5 % / Biso Wilson estimate: 29.61 Å2 / CC1/2: 0.986 / Rmerge(I) obs: 0.282 / Net I/σ(I): 5.7 |
| Reflection shell | Resolution: 2.25→2.3 Å / Redundancy: 6.6 % / Rmerge(I) obs: 2.132 / Mean I/σ(I) obs: 1.1 / % possible all: 97.6 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 5IH3 Resolution: 2.25→47.716 Å / SU ML: 0.3 / Cross valid method: FREE R-VALUE / σ(F): 1.97 / Phase error: 24
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.25→47.716 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller






















 PDBj
PDBj








