| 登録情報 | データベース: PDB / ID: 5ggg
|
|---|
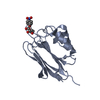
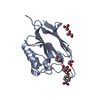
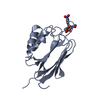
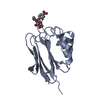
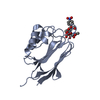
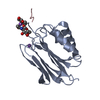
| タイトル | Crystal structure of human protein O-mannose beta-1,2-N-acetylglucosaminyltransferase form I |
|---|
 要素 要素 | Protein O-linked-mannose beta-1,2-N-acetylglucosaminyltransferase 1 |
|---|
 キーワード キーワード | TRANSFERASE / SUGAR BINDING PROTEIN / glycosyltransferase / O-mannosylation / alpha-dystroglycan |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
beta-1,3-galactosyl-O-glycosyl-glycoprotein beta-1,3-N-acetylglucosaminyltransferase activity / Defective POMGNT1 causes MDDGA3, MDDGB3 and MDDGC3 / O-linked glycosylation / localization of cell / protein O-linked glycosylation via mannose / protein O-linked glycosylation via N-acetyl-galactosamine / reactive gliosis / acetylglucosaminyltransferase activity / basement membrane organization / dentate gyrus development ...beta-1,3-galactosyl-O-glycosyl-glycoprotein beta-1,3-N-acetylglucosaminyltransferase activity / Defective POMGNT1 causes MDDGA3, MDDGB3 and MDDGC3 / O-linked glycosylation / localization of cell / protein O-linked glycosylation via mannose / protein O-linked glycosylation via N-acetyl-galactosamine / reactive gliosis / acetylglucosaminyltransferase activity / basement membrane organization / dentate gyrus development / protein O-linked glycosylation / 転移酵素; グリコシル基を移すもの; 六炭糖残基を移すもの / myelination / sensory perception of sound / manganese ion binding / carbohydrate binding / gene expression / Golgi membrane / membrane類似検索 - 分子機能 Protein O-linked-mannose beta-1,2-N-acetylglucosaminyltransferase 1, PANDER-like domain / : / Glycosyl transferase, family 13 / ILEI/PANDER domain / GNT-I family / Interleukin-like EMT inducer / GG-type lectin domain profile. / Spore Coat Polysaccharide Biosynthesis Protein SpsA; Chain A / Spore Coat Polysaccharide Biosynthesis Protein SpsA; Chain A / Nucleotide-diphospho-sugar transferases ...Protein O-linked-mannose beta-1,2-N-acetylglucosaminyltransferase 1, PANDER-like domain / : / Glycosyl transferase, family 13 / ILEI/PANDER domain / GNT-I family / Interleukin-like EMT inducer / GG-type lectin domain profile. / Spore Coat Polysaccharide Biosynthesis Protein SpsA; Chain A / Spore Coat Polysaccharide Biosynthesis Protein SpsA; Chain A / Nucleotide-diphospho-sugar transferases / Alpha-Beta Complex / Alpha Beta類似検索 - ドメイン・相同性 Protein O-linked-mannose beta-1,2-N-acetylglucosaminyltransferase 1類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 3 Å 単波長異常分散 / 解像度: 3 Å |
|---|
 データ登録者 データ登録者 | Kuwabara, N. / Senda, T. / Kato, R. |
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2016 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2016
タイトル: Carbohydrate-binding domain of the POMGnT1 stem region modulates O-mannosylation sites of alpha-dystroglycan
著者: Kuwabara, N. / Manya, H. / Yamada, T. / Tateno, H. / Kanagawa, M. / Kobayashi, K. / Akasaka-Manya, K. / Hirose, Y. / Mizuno, M. / Ikeguchi, M. / Toda, T. / Hirabayashi, J. / Senda, T. / Endo, T. / Kato, R. |
|---|
| 履歴 | | 登録 | 2016年6月16日 | 登録サイト: PDBJ / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2016年8月10日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2016年8月31日 | Group: Database references |
|---|
| 改定 1.2 | 2020年2月26日 | Group: Data collection / Database references / Derived calculations
カテゴリ: citation / diffrn_source / pdbx_struct_oper_list
Item: _citation.journal_id_CSD / _diffrn_source.pdbx_synchrotron_site / _pdbx_struct_oper_list.symmetry_operation |
|---|
| 改定 1.3 | 2024年10月16日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  単波長異常分散 / 解像度: 3 Å
単波長異常分散 / 解像度: 3 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2016
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2016 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5ggg.cif.gz
5ggg.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5ggg.ent.gz
pdb5ggg.ent.gz PDB形式
PDB形式 5ggg.json.gz
5ggg.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5ggg_validation.pdf.gz
5ggg_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5ggg_full_validation.pdf.gz
5ggg_full_validation.pdf.gz 5ggg_validation.xml.gz
5ggg_validation.xml.gz 5ggg_validation.cif.gz
5ggg_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/gg/5ggg
https://data.pdbj.org/pub/pdb/validation_reports/gg/5ggg ftp://data.pdbj.org/pub/pdb/validation_reports/gg/5ggg
ftp://data.pdbj.org/pub/pdb/validation_reports/gg/5ggg リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: POMGNT1, MGAT1.2, UNQ746/PRO1475 / 細胞株 (発現宿主): HEK-293T / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: POMGNT1, MGAT1.2, UNQ746/PRO1475 / 細胞株 (発現宿主): HEK-293T / 発現宿主:  Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Photon Factory
Photon Factory  / ビームライン: AR-NE3A / 波長: 1 Å
/ ビームライン: AR-NE3A / 波長: 1 Å 解析
解析 単波長異常分散 / 解像度: 3→44.684 Å / SU ML: 0.4 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 24.21
単波長異常分散 / 解像度: 3→44.684 Å / SU ML: 0.4 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 24.21  ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj


